La leucèmia mieloide aguda en adults
La leucèmia mieloide aguda és el tipus de leucèmia més prevalent en la població adulta. La leucèmia afecta cada any més de 6.000 persones a l’Estat espanol.
La informació proporcionada a www.fcarreras.org serveix per donar suport a la relació que existeix entre els pacients/visitants d’aquest lloc web i del seu metge, però no per reemplaçar-la.
Informació proporcionada per la Dra. Irene Garcia Cadenas. Metgessa especialista en Hematologia de l’Hospital Sant Pau de Barcelona. Col·legi de Metges de Barcelona (Col. 42.612).

Álvaro, 52 anys
Leucèmia mieloide aguda.
“Durant tot el procés de curació de la meva leucèmia, només tenia un tòtem: Aquí i ara. Et convido a compartir la meva experiència llegint el meu ebook”
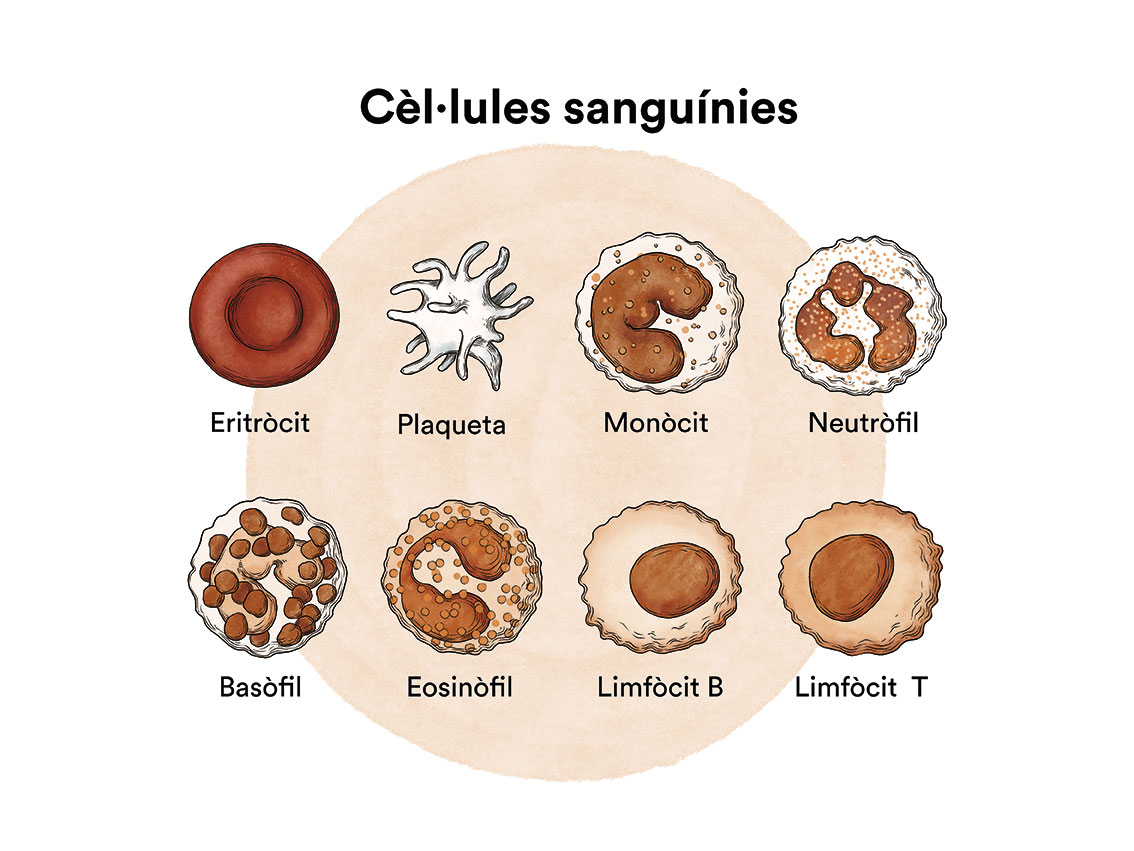
Què és la leucèmia, la medul·la òssia i quins són els tipus de cèl·lules sanguínies?
La leucèmia és un tipus de càncer de les cèl·lules de la sang que s’origina a la medul·la òssia. Vegeu apartat Leucèmia, medul·la òssia i cèl·lules sanguínies.
Com hem vist a ‘Leucèmia, medul·la òssia i cèl·lules sanguínies’, la medul·la òssia elabora les cèl·lules mare sanguínies (cèl·lules immadures) que, amb el temps, es transformaran en cèl·lules sanguínies madures. Una cèl·lula mare sanguínia es converteix en una cèl·lula mare mieloide o en una cèl·lula mare limfoide.
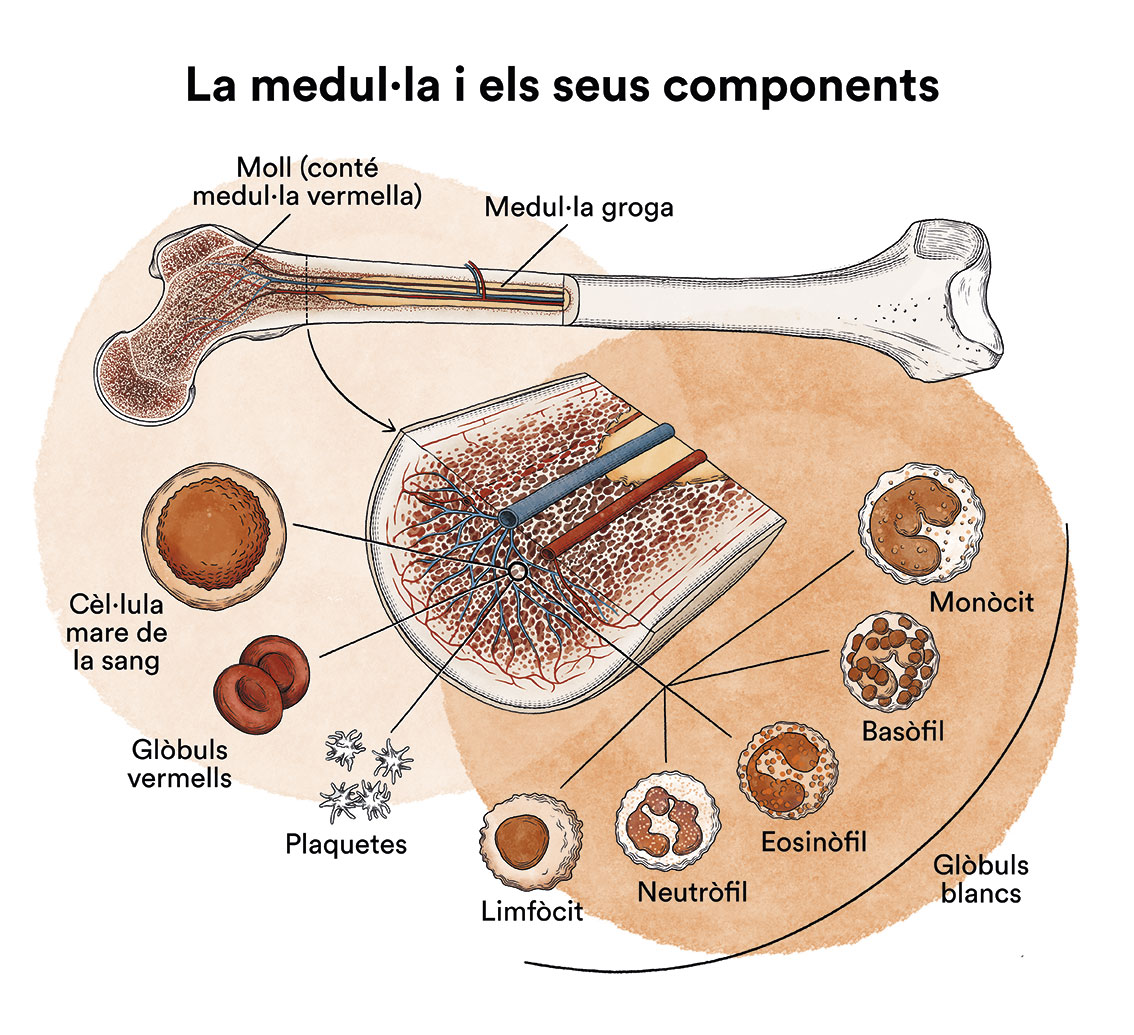
Una cèl·lula mare mieloide es converteix en un dels tres tipus de glòbuls sanguinis madurs:
- Glòbuls vermells, que transporten l’oxigen a altres teixits i òrgans del cos
- Granulòcits, glòbuls blancs que ajuden a combatre infeccions i altres malalties
- Plaquetes, que col·laboren en la coagulació de la sang i eviten dessagnaments.
Les leucèmies agudes són un grup de malalties neoplàstiques caracteritzades per la transformació maligna i producció incontrolada de cèl·lules hematopoètiques immadures. Existeixen dos tipus principals en funció de la línia cel·lular afectada: la leucèmia limfoblàstica aguda (LAL) i la leucèmia mieloblàstica o mieloide aguda (LMA).
Què és la leucèmia mieloide aguda en adults i a qui afecta?
La leucèmia mieloide aguda (també coneguda com a leucèmia mieloblàstica aguda, leucèmia mielògena aguda, leucèmia granulocítica aguda o LMA) es el tipus més comú de leucèmia en adults, si bé de vegades es pot diagnosticar en nens. La mitjana d’edat d’aparició són 64 anys i la majoria dels pacients se situen en la franja dels 60-70 anys. Aquest tipus de leucèmia representa el 40 % de totes les leucèmies en el món occidental. La seva incidència en el nostre país s’estima en 15 nous casos per milió d’habitants i any.
 De vegades la leucèmia mieloide aguda és l’etapa final d’altres malalties com ara les síndromes mielodisplàstiques o les síndromes mieloproliferatives cròniques. De la mateixa manera, la leucèmia mieloide aguda pot aparèixer anys després d’haver rebut quimioteràpia i/o radioteràpia per al tractament d’una altra neoplàsia; aquestes leucèmies mieloides agudes clàssicament s’han denominat leucèmies secundàries.
De vegades la leucèmia mieloide aguda és l’etapa final d’altres malalties com ara les síndromes mielodisplàstiques o les síndromes mieloproliferatives cròniques. De la mateixa manera, la leucèmia mieloide aguda pot aparèixer anys després d’haver rebut quimioteràpia i/o radioteràpia per al tractament d’una altra neoplàsia; aquestes leucèmies mieloides agudes clàssicament s’han denominat leucèmies secundàries.
Una altra particularitat és que la seva incidència és més elevada entre persones amb determinades alteracions cromosòmiques com ara la síndrome de Down o l’Anèmia de Fanconi.
Quines són les causes de la leucèmia mieloide aguda en adults?
Les causes específiques que originen la majoria dels casos de leucèmia mieloide aguda no es coneixen. No obstant això, existeixen alguns factors de risc que s’associen amb una probabilitat més alta de desenvolupar una leucèmia mieloide aguda. Un factor de risc és tot allò que augmenta la probabilitat que una persona pugui desenvolupar càncer.
Els factors de risc associats a la leucèmia mieloide aguda són, segons l’American Society of Clinical Oncology:
- L’edat. La leucèmia mieloide aguda és més freqüent en els adults grans, però es presenta en totes les edats.
- Trastorns genètics. La leucèmia mieloide aguda ocorre més freqüentment en persones amb els trastorns heretats següents:
- Síndrome de Down
- Atàxia-telangiectàsia
- Síndrome de Li-Fraumeni (en anglès)
- Síndrome de Klinefelter
- Anèmia de Fanconi
- Síndrome de Wiskott-Aldrich
- Síndrome de Bloom
- Síndrome de trastorn plaquetari familiar
- Mutacions de la línia germinal que estiguin presents al moment del naixement; les més freqüents són canvis en els gens GATA2, ETV6, CEBPA i RUNX1.
- Dosis altes de radiació. Les persones que han estat exposades a nivells alts de radiació poden ser més propenses a desenvolupar una leucèmia mieloide aguda. Això inclou persones que han rebut radioteràpia per a un altre càncer o supervivents a llarg termini de bombes atòmiques o accidents de fuites de radioactivitat. No s’ha demostrat que els camps electromagnètics generats per línies d’energia elèctrica d’alt voltatge causin leucèmia mieloide aguda. L’ús de telèfons cel·lulars no és un factor de risc de leucèmia mieloide aguda conegut.
- Quimioteràpia. Les persones que han rebut quimioteràpia per a un altre càncer poden desenvolupar una leucèmia mieloide aguda relacionada amb la teràpia anterior.
- Substàncies químiques. El contacte prolongat amb productes que contenen benzè (que es troba en el petroli, el fum de cigarreta i alguns llocs de treball industrials) augmenta el risc de leucèmia mieloide aguda. Tot i això, no s’ha demostrat que l’exposició a dissolvents industrials i a tints capil·lars augmenti el risc d’una persona a desenvolupar leucèmia.
- Altres trastorns de la medul·la òssia. És possible que les persones que tinguin altres trastorns de la medul·la òssia, inclosos trastorns mieloproliferatius, desenvolupin leucèmia mieloide aguda amb el temps. “Mielo” significa “de la medul·la òssia”, i “proliferatiu” significa “multiplicar-se en abundància”. Aquestes afeccions inclouen: Leucèmia Mieloide Crònica, Policitèmia vera, Mielofibrosi i Trombocitosi essencial. També existeix un risc més alt de progressió a una LMA en persones amb Síndromes mielodisplàstiques o Anèmia aplàsica.
La leucèmia, com altres tipus de càncer, no és contagiosa. Vegeu apartat Leucèmia, medul·la òssia i cèl·lules sanguínies.
Com es classifica la leucèmia mieloide aguda?
Als anys setanta un grup d’experts francesos, nord-americans i britànics va definir la classificació FAB, per diferenciar les LAM en subtipus, de l’M0 a l’M7, segons el tipus de cèl·lula de la qual la leucèmia es desenvolupa i com de madures estan les cèl·lules. Això es va basar principalment en l’aparença de les cèl·lules leucèmiques en el microscopi després d’una tinció de rutina i en l’expressió de determinades proteïnes en la cèl·lula leucèmica (immunofenotip).
| Tipus FAB | Definició | Freqüència |
|---|---|---|
| LMA 0 | Leucèmia mieloide aguda sense diferenciació localitzada | 2-5% |
| LMA 1 | Leucèmia mieloide aguda sense maduració | 15-20% |
| LMA 2 | Leucèmia mieloide aguda amb maduració | 25-30% |
| LMA 3 | Leucèmia promielocítica aguda (amb translocació t15;17) | 10-15% |
| LMA 4 | Leucèmia mielomonocítica aguda (LMMA) | 15-30% |
| LMA 5 | Leucèmia monocítica aguda (LMoA) | 10-15% |
| LMA 6 | Eritroleucèmia | 3-4% |
| LMA 7 | Leucèmia megacariocítica aguda | 1% |
Tot i això, actualment existeixen dues noves classificacions recentment actualitzades (WHO 2022 i ICC 2022) que se centren en les alteracions citogenètiques i moleculars de la LAM, les quals tenen molta relació amb el pronòstic i poden ser susceptibles d’algun tractament dirigit amb fàrmacs diana.
Les alteracions citogenètiques més habituals a les LMA són les translocacions; desplaçament d’un fragment d’un cromosoma a un altre cromosoma (s’indica com a t). Exemple: t(8;21), un fragment del cromosoma 8 es desplaça a una zona del cromosoma 21; o dins del mateix cromosoma, t(16;16). També poden observar-se inversions citogenètiques: quan un segment cromosòmic canvia de sentit dins del mateix cromosoma (s’indica com a inv).
Les translocacions o inversions detectades en els estudis citogenètics generen reordenaments dels gens localitzats a les regions cromosòmiques afectades. Aquests estudis es representen pels noms dels gens implicats. D’aquesta manera, en el cas de la t(8;21) generarà un reordenament dels gens RUNX1 i RUNX1T1. Les alteracions citogenètiques han demostrat ser un factor pronòstic molt important i són utilitzades en la majoria dels protocols de tractament per determinar la seva intensitat.
En els darrers anys s’han anat descrivint mutacions en un o diversos gens de les cèl·lules leucèmiques de la majoria dels pacients. Algunes d’elles han demostrat tenir importància pronòstica i ser rellevants per definir la intensitat del tractament
Per això mateix, avui dia es valoren tant les alteracions cromosòmiques com les moleculars per establir els protocols de tractament.
Conèixer el subtipus de leucèmia mieloide aguda és molt important, ja que afecta tant al pronòstic d’un pacient com a la tria del millor tractament. Per exemple, el subtipus de leucèmia promielocítica aguda (LMA3) es tracta sovint amb medicaments que són diferents dels utilitzats per a altres subtipus de leucèmia mieloide aguda.
Segons les anomalies cromosòmiques (citogenètiques) es poden establir alguns subtipus de leucèmia mieloide aguda amb pronòstic més o menys favorable. Aquests factors pronòstics ajuden els hematòlegs a determinar el risc que la leucèmia d’una persona torni després del tractament i, per tant, si ha de rebre un tractament més o menys intensiu. Alguns d’aquests criteris són:
- Anomalies favorables:
- Translocació entre els cromosomes 8 i 21 (vist amb més freqüència en pacients amb LMA2)
- Translocació o inversió del cromosoma 16
- Translocació entre els cromosomes 15 i 17 (vist amb més freqüència en pacients amb LMA3 – leucèmia promielocítica aguda)
- Anomalies desfavorables:
- Deleció (pèrdua) de part del cromosoma 5 o 7
- Translocació o inversió del cromosoma 3
- Translocació entre els cromosomes 6 i 9
- Translocació entre els cromosomes 9 i 22
- Anomalies del cromosoma 11 (en el lloc q23)
- Pèrdua d’un cromosoma, per la qual cosa la cèl·lula només té una còpia en comptes de les dues normals (monosomia)
- Canvis complexos (que impliquen 3 o més cromosomes)
Els canvis moleculars en el moment del diagnòstic també són molt importants per comprendre el pronòstic i les opcions de tractament juntament amb els canvis cromosòmics. Els canvis genètics moleculars més freqüents relacionats amb el pronòstic per a les persones amb LMA inclouen: NPM1, CEBP alfa, FLT3, RUNX1, ASXL1, TP53, IDH1 i IDH2.

Cristina
Leucemia mieloide aguda.
“Fa 10 anys em van diagnosticar una leucèmia mieloide aguda. Recordo amb angoixa l’època de proves, la incertesa, no saber què podia tenir. Per fi va arribar el diagnòstic, els tractaments i un trasplantament de medul·la òssia. De tota la meva malaltia amb allò que em quedo és amb la demostració d’amor brutal que vaig tenir dels meus amics i família. Sentia tones d’afecte que m’ajudaven a continuar lluitant cada dia. També em quedo amb l’equip mèdic tan fantàstic que vaig conèixer als dos hospitals que em van tractar. Finalment, vaig aprendre a centrar-me en el present, en el fet que no es pot planificar, que cal acceptar les coses segons van venint amb paciència i esperança. A viure cada dia i concentrar-me en aquell dia que tenia per davant, ni més ni menys”.
Quins són els símptomes de la leucèmia mieloide aguda en adults?
L’interval entre l’aparició dels primers símptomes i el diagnòstic és habitualment inferior a 3 mesos a causa del caràcter agut de la malaltia. Els símptomes dels pacients amb leucèmia mieloide aguda són conseqüència de l’anèmia produïda pel dèficit de glòbuls vermells (sensació de fatiga, debilitat, mareigs, pal·lidesa); del dèficit de plaquetes (hematomes, hemorràgies de genives, nasals o de qualsevol altre focus); i del dèficit de granulòcits (febre i infeccions).
Vegeu leucèmia, medul·la òssia i cèl·lules sanguínies.
De vegades pot observar-se el creixement dels ganglis limfàtics, el fetge o la melsa. Es pot observar, així mateix, simptomatologia específica de la infiltració del sistema nerviós central (mal de cap, vòmits, somnolència, etc.), pell (nòduls disseminats o zones de pell engreixada), mucoses (inflamació de les genives), ocular (visió borrosa, ceguera), entre altres.
Com es diagnostica la leucèmia mieloide aguda en adults?
A part dels estudis bàsics en sang i medul·la òssia (morfologia, recompte, immunofenotip) a realitzar durant tota la leucèmia, els estudis citogenètics (per detectar anomalies cromosòmiques concretes) i estudis moleculars (per detectar alteracions genètiques específiques) són fonamentals per tipificar i classificar la malaltia. Determinades alteracions citogenètiques i moleculars es corelacionen amb la sensibilitat al tractament i el risc de recaiguda.
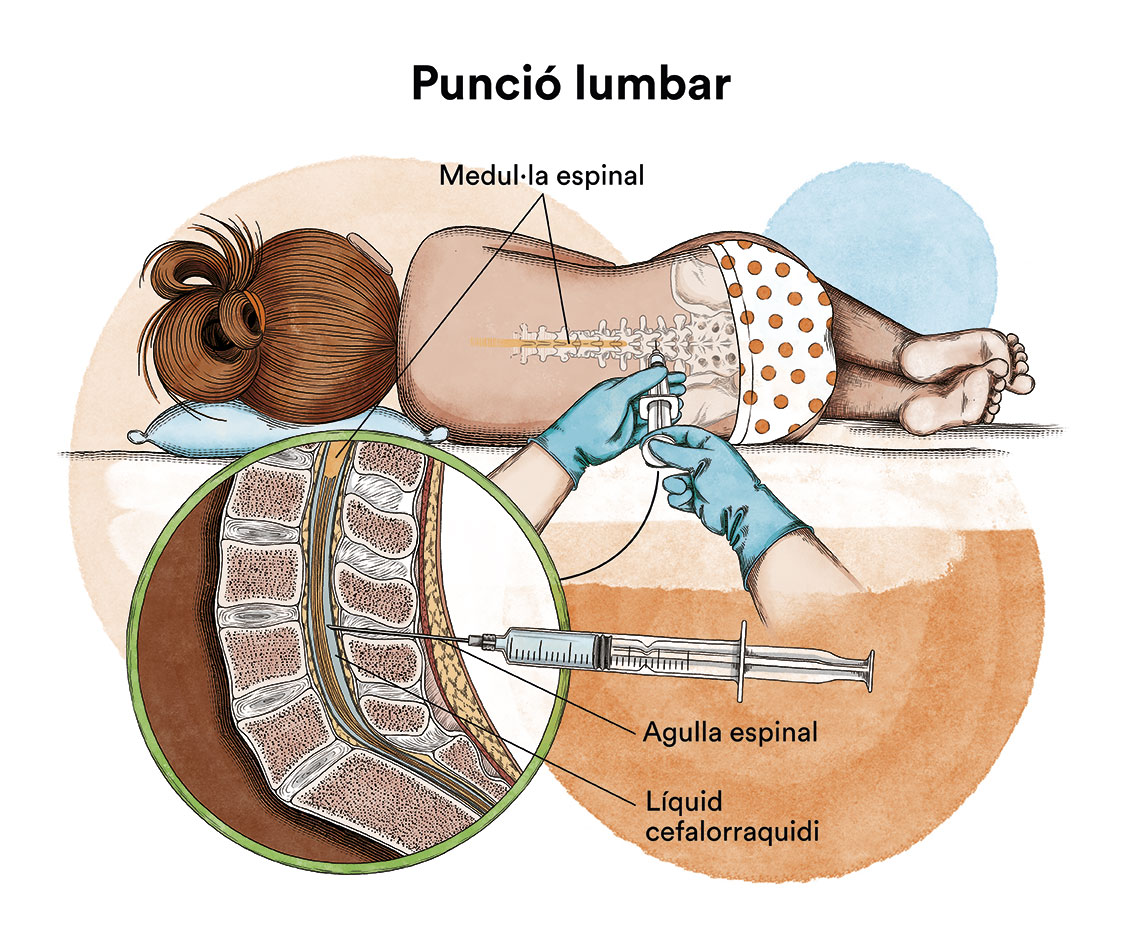
En funció dels símptomes i del subtipus de leucèmia, de vegades s’ha d’estudiar si la malaltia s’ha estès al sistema nerviós central i efectua, per fer-ho, una punció lumbar amb l’objectiu d’analitzar el líquid que embolica aquest sistema (líquid cefaloraquidi) i, si estigués afectat, s’hauria d’administrar quimioteràpia local (intratecal).
Quin és el tractament de la leucèmia mieloide aguda en adults?
El tractament de la leucèmia mieloide aguda es determinarà de forma individualitzada, tenint en compte el subtipus de la malaltia, l’edat, l’estat general del pacient i, posteriorment, la resposta al tractament inicial.
L’objectiu principal de qualsevol tractament en les leucèmies o altres hemopaties malignes és aconseguir la remissió completa de la malaltia a nivell molecular.
El tractament quimioteràpic més utilitzat fins ara en pacients de menys de 70 anys inclou 2 fases inducció a la remissió i de post-remissió o consolidació. La fase de manteniment amb dosis baixes de quimioteràpia tan utilitzada durant períodes molt llargs en la leucèmia limfoblàstica aguda (LLA) no s’ha mostrat eficaç en la leucèmia mieloide aguda.
Generalment, el tractament de la leucèmia mieloide aguda s’ha de començar el més aviat possible després del diagnòstic, si bé en funció de l’agressivitat de presentació podem esperar uns dies per tenir la informació completa sobre les característiques principals de la malaltia i així dirigir millor el tractament, sempre que l’estat general del pacient sigui bo i fent un seguiment clínic estret.
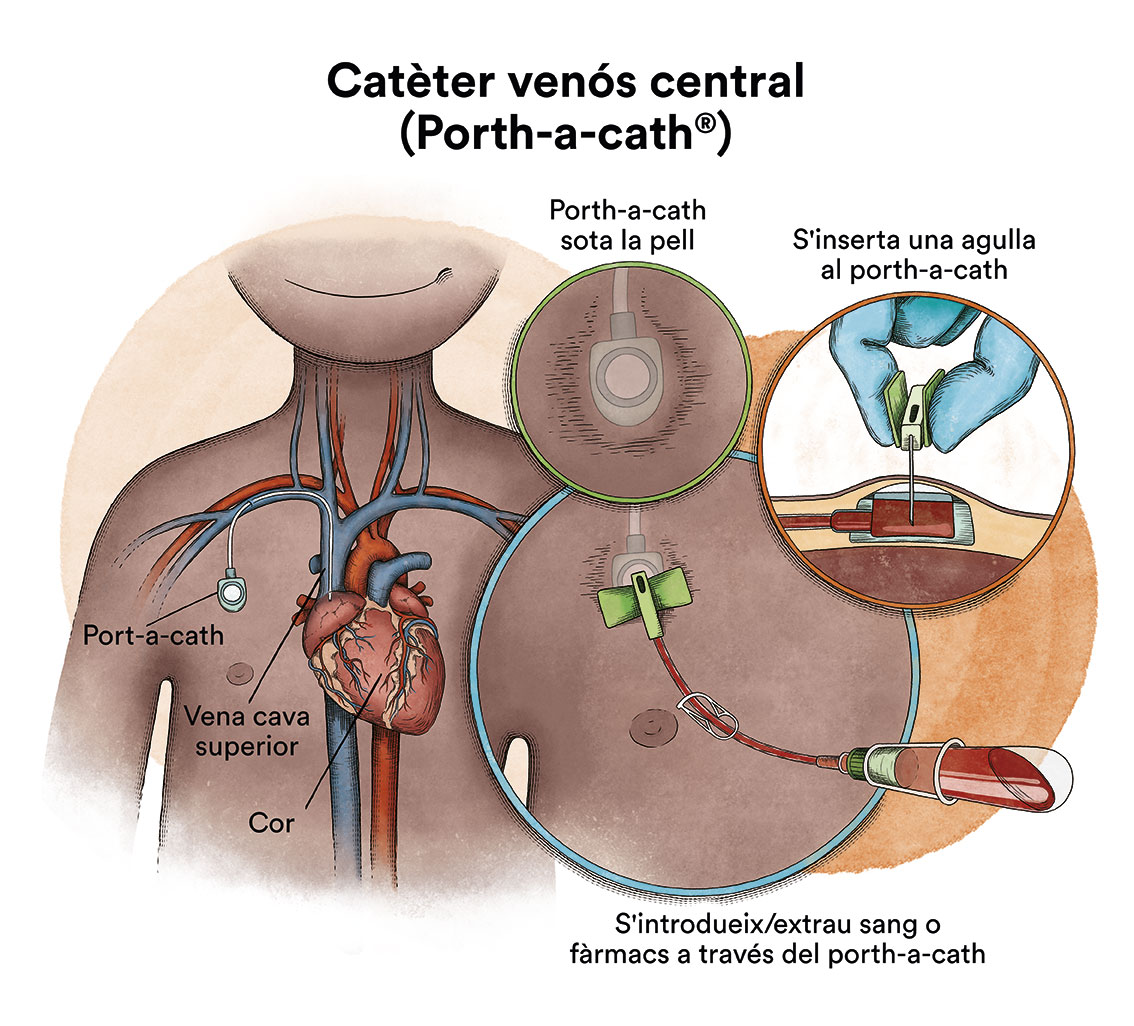
Per l’administració de quimioteràpia i/o de transfusions sanguínies, en general, un dels primers passos després del diagnòstic serà la col·locació d’un catèter venós central per facilitar el tractament, ja que les venes perifèriques (dels braços) no són suficientment resistents per suportar una via per on administrar el tractament, i suport general (sèrums, transfusions, quimioteràpia, etc.).
1. Fase d’inducció a la remissió (excepte en la leucèmia promielocítica aguda. Vegeu més endavant)
L’equip d’hematologia considerarà el tractament a utilitzar en funció de l’edat i l’estat general del pacient i la presència d’altres malalties (anomenades comorbiditats), a part d’altres aspectes com les alteracions genètiques o cromosòmiques concretes de la leucèmia.
El tractament estàndard d’inducció en pacients sense comorbiditats rellevants i fins els 70 anys es basa habitualment en una quimioteràpia intensiva que inclou diversos agents antineoplàstics per via intravenosa, amb l’objectiu d’aconseguir que desapareguin les cèl·lules leucèmiques de la sang i la medul·la òssia (remissió completa citològica), i que permetin la producció normal de les altres cèl·lules sanguínies. Es considera que un pacient ha assolit la remissió completa citològica quan la xifra de blastos a la medul·la òssia és inferior al 5 %. Aquesta situació clínica s’acostuma a assolir en el 70-80 % del total dels pacients després del primer cicle de tractament, si bé de vegades pot ser necessari administrar dos cicles d’inducció per assolir la remissió, o inclús canviar d’estratègia terapèutica.
 Els dos agents quimioteràpics utilitzats són: la citarabina (ara-C) i un medicament de la família de les antraciclines, com ara la daunorubicina (daunomycin) o idarubicina. Sovint aquesta pauta es diu règim de 7 + 3, ja que consisteix a rebre la citarabina contínuament durant 7 dies, juntament amb infusions curtes d’antraciclina en cadascun dels 3 primers dies.
Els dos agents quimioteràpics utilitzats són: la citarabina (ara-C) i un medicament de la família de les antraciclines, com ara la daunorubicina (daunomycin) o idarubicina. Sovint aquesta pauta es diu règim de 7 + 3, ja que consisteix a rebre la citarabina contínuament durant 7 dies, juntament amb infusions curtes d’antraciclina en cadascun dels 3 primers dies.
De vegades, en els casos on existeix una molècula diana, un tercer medicament podria afegir-se també per intentar millorar les probabilitats de remissió:
- En cas de ser-hi present la mutació en el gen FLT3, es podria administrar el medicament de teràpia dirigida midostaurin (Rydapt®) juntament amb quimioteràpia. Aquest medicament s’administra dues vegades al dia en forma de pastilla. S’estan desenvolupant també nous tractaments, amb aquesta mateixa molècula diana, en forma d’assaig clínic fins que obtinguin la seva aprovació, si escau, i que generalment s’administren per via oral, i juntament amb la quimioteràpia intravenosa.
- Per a pacients les cèl·lules leucèmiques dels quals expressen la proteïna CD33, el medicament de teràpia dirigida ozogamicina gemtuzumab (Mylotarg®) es podria agregar a la quimioteràpia en pacients de risc favorable o intermedi.
- Cal remarcar que, en alguns perfils concrets de pacients joves, el tractament d’elecció pot no ser el 7+3 sinó VYXEOS (una adaptació del 7+3 aprovat en les leucèmies secundàries en relació amb la quimioteràpia prèvia o bé amb antecedent de mielodisplàsia, leucèmia mieloide aguda relacionada amb el tractament (LMA-t) o LMA amb canvis relacionats amb mielodisplàsia), o la combinació de venetoclax amb azacitidina.
En els casos en què la leucèmia s’ha propagat al sistema nerviós, també es pot administrar quimioteràpia en el líquid cefaloraquidi mitjançant puncions lumbars (quimioteràpia intratecal).

Cal remarcar que la primera fase de tractament acostuma a requerir un ingrés hospitalari prolongat d’aproximadament 4 o 5 setmanes.
 2. Fase de tractament de post-remissió o consolidació
2. Fase de tractament de post-remissió o consolidació
Aquesta fase té per finalitat mantenir la remissió completa i aprofundir-la, mitjançant la destrucció de les cèl·lules leucèmiques residuals (malaltia mínima residual) que en qualsevol moment podrien començar a reproduir-se i causar una recaiguda.
En els pacients amb leucèmia mieloide aguda existeixen tres opcions de tractament de post-remissió:
- Quimioteràpia de consolidació
- Quimioteràpia de consolidació seguida de trasplantament autòleg de medul·la òssia (del mateix pacient – trasplantament autòleg de progenitors hematopoètics)
- Quimioteràpia de consolidació seguida de trasplantament de medul·la òssia al·logènic (de donant compatible, familiar o anònim – trasplantament al·logènic de progenitors hematopoètics)
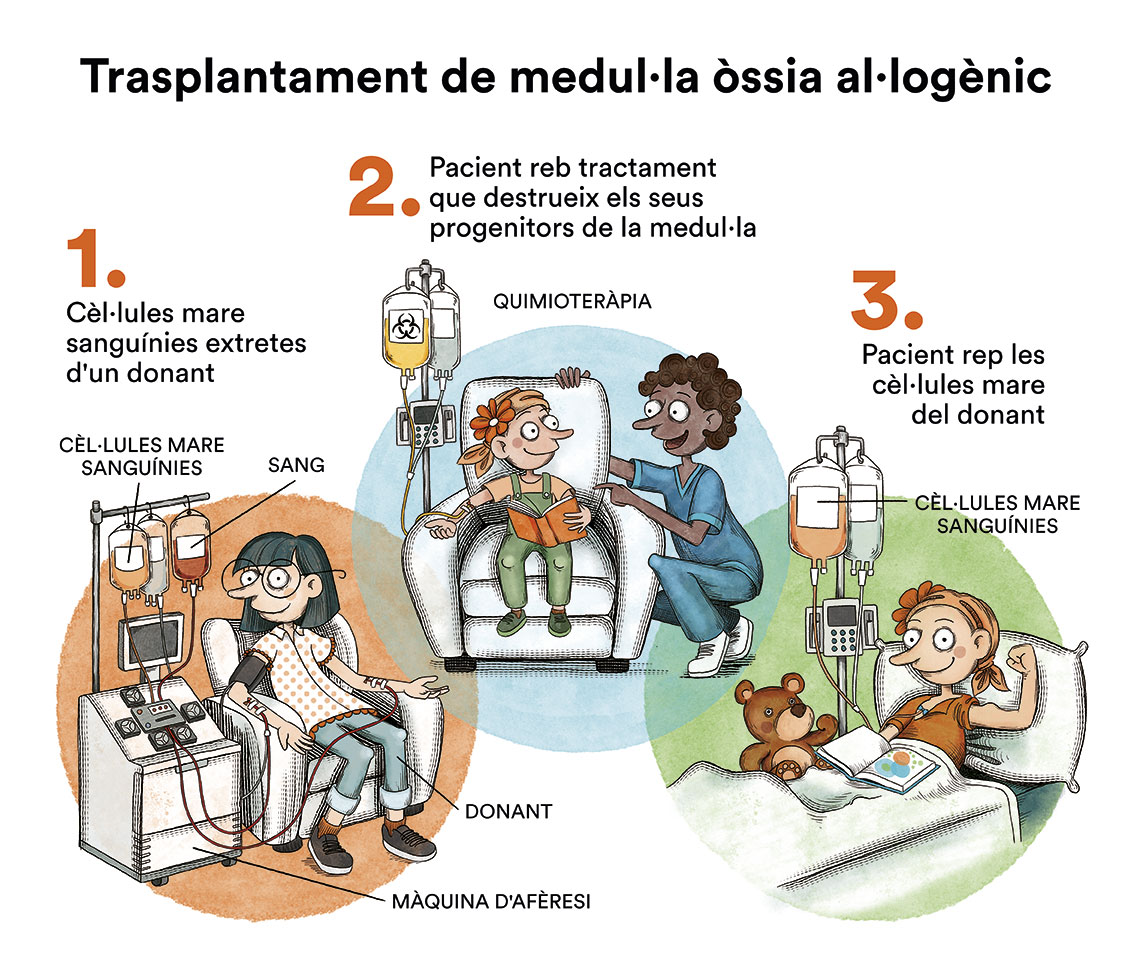
La primera opció (quimioteràpia de consolidació) és l’elecció en pacients amb pronòstic favorable (sota risc de recidiva després del tractament quimioteràpic intensiu) i sense malaltia mínima residual detectable, que s’estudia amb proves de laboratori complementàries (citometria i estudis moleculars). No hi ha prou evidències per recomanar quimioteràpia sola o quimioteràpia seguida de trasplantament autòleg de medul·la òssia i, per tant, es decidirà de forma individualitzada per a cada pacient.
De la mateixa manera, el règim òptim a utilitzar per a la consolidació i el nombre de cicles de quimioteràpia a administrar tampoc estan del tot establerts. No obstant això, quan es realitza un trasplantament s’acostumen a administrar 1 o 2 cicles de consolidació, mentre que quan no es realitza trasplantament se sol administrar un mínim de dos cicles.
En alguns pacients amb subtipus de leucèmia mieloide aguda considerats de risc intermedi o alt (elevat risc de recaiguda de la malaltia malgrat la quimioteràpia o després d’una primera recaiguda), i amb edats inferiors a 70 anys i sense problemes mèdics importants addicionals, està indicada la realització d’un trasplantament de progenitors hematopoètics (medul·la òssia, sang perifèrica o sang de cordó umbilical) a partir d’un donant compatible (trasplantament al·logènic), idealment un germà histocompatible o, si no n’hi hagués, un donant voluntari no emparentat compatible localitzat a escala mundial o una unitat de sang de cordó umbilical. També existeix l’opció de realitzar el trasplantament amb familiars 50 % compatibles (haploidèntic) amb resultats molt similars als trasplantaments amb més compatibilitat.
En els pacients de més de 70 anys, la decisió de realitzar o no un trasplantament al·logènic s’adopta de forma individualitzada. En aquests casos, l’important no és l’edat en sí, sinó l’estat general del pacient, la tolerància als tractaments previs, i la disponibilitat d’un bon donant. Aplica igualment a pacients de menys de 70 anys, però amb comorbiditats rellevants que no el fan apte per rebre un tractament.
En els pacients d’edat avançada i amb un mal estat funcional previ, atesa l’esperable mala tolerància a la quimioteràpia intensiva s’adopten estratègies terapèutiques diferents. Les més utilitzades són les quimioteràpies a baixes dosis o els agents hipometilants, com ara la Decitabina o l’Azacitidina, que tenen com a finalitat retardar al màxim la progressió de la malaltia, i causar la menys toxicitat possible i prioritzar la qualitat de vida.
El tractament de la leucèmia mieloide aguda relacionada amb el tractament o secundària a altres malalties hematològiques no difereix gaire de la resta de leucèmies mieloides agudes, tot i que la probabilitat d’assolir una remissió completa mantinguda és inferior per la seva resistència més elevada a les quimioteràpies. En aquests casos, si és factible, és habitual efectuar un trasplantament al·logènic de progenitors hematopoètics per ser l’aproximació terapèutica amb més possibilitats curatives.

Laura
Leucèmia mieloide aguda.
“Quan el meu fill petit tenia només 6 mesos, em van diagnosticar una leucèmia mieloide aguda. Va ser un moment molt difícil, però gràcies als professionals de l’hospital, als meus fills i a la donació de medul·la òssia del meu germà avui estic viva. Visc millor i més feliç”.
Subtipus específics: leucèmia promielocítica aguda i pacients amb síndrome de Down
Leucèmia Promielocítica Aguda
Una de les leucèmies que més s’ha beneficiat d’una estratègia terapèutica individualitzada és la leucèmia aguda promielocítica (LPA). En les darreres dècades, gràcies a la investigació científica, s’ha obtingut una millora substancial en el seu tractament, i ha passat de ser un subtipus de LMA amb molt mal pronòstic a ser una malaltia que en la majoria de casos respon molt bé al tractament. Aquest tipus de leucèmia es caracteritza perquè té una translocació entre els cromosomes 15 i 17 [t(15:17)], que afecta el receptor de l’àcid retinoic alfa (RARα o RARA) i que li confereix una alta sensibilitat al tractament amb àcid holotransretinoic (ATRA). És per aquest motiu que aquest tipus de leucèmia rep un tractament diferent de l’utilitzat en la resta de LMA basat en la utilització d’ATRA.
La leucèmia promielocítica aguda (LPA) representa el 10-15 % de totes les LMA. L’edat mitjana d’aquests pacients és de 40 anys.
L’interval entre l’aparició dels primers símptomes i el diagnòstic de la leucèmia promielocítica aguda és habitualment inferior a dos mesos a causa del caràcter agut de la malaltia. A part dels símptomes atribuïbles a l’anèmia produïda pel dèficit de glòbuls vermells (sensació de fatiga, debilitat, mareigs, pal·lidesa), aquesta leucèmia es caracteritza per afectar de forma molt marcada la coagulació. Per això mateix, les hemorràgies acostumen a ser presents en fins el 75 % dels pacients en forma d’hematomes a la pell i mucoses; o dessagnaments a qualsevol altra regió, dels quals els més perillosos són els del sistema nerviós central. De fet, les hemorràgies són responsables del 60 % de les morts en aquesta fase inicial de la malaltia, per la qual cosa és molt important el diagnòstic ràpid de la malaltia amb inici immediat d’ATRA i factors que milloren la coagulació. Com a la resta de leucèmies, un nombre important dels pacients poden presentar febre per infeccions recurrents secundàries causades per la manca de granulòcits. És poc freqüent observar creixement de ganglis limfàtics, fetge o melsa.
A part dels estudis bàsics en sang i medul·la òssia (morfologia, recompte i immunofenotip) a realitzar en totes les leucèmies, en la leucèmia promielocítica aguda adquireixen especial rellevància la disponibilitat ràpida dels resultats de citogenètica i la biologia molecular, que confirmaran la sospita clínica. El 80 % dels pacients presenten la translocació t(15;17) i el 99 % el gen PML-RARα, que permeten establir un diagnòstic de seguretat amb importants implicacions terapèutiques.
En aquest tipus de leucèmia aguda, el tractament inicial també dependrà del risc de recaiguda. Per calcular-lo, les classificacions més freqüents utilitzen el nombre de leucòcits i plaquetes en el moment del diagnòstic.
En els pacients amb risc favorable (leucòcits < 10000/mm3 i plaquetes > 40000/mm3), el tractament d’inducció utilitza l’ATRA, pertanyent a la família de la vitamina A, conjuntament amb triòxid d’arsènic (ATO). L’ATRA també es coneix com a tretinoïna (Vesanoid®), i es caracteritza per eliminar l’anomalia del PML/RARα i induir d’aquesta manera als promielòcits a desenvolupar-se en cèl·lules madures (neutròfils).
En els pacients de risc advers (leucòcits > 10000/mm3) s’associa, a més, un agent quimioteràpic, habitualment de la classe de les antraciclines (daunorubicina o idarubicina) amb l’objectiu de reduir més ràpidament el nombre de cèl·lules de la malaltia a la sang.
S’ha de tenir en compte, com a efectes secundaris d’aquest tractament, a part dels comentats prèviament en relació amb la leucèmia (infeccions, hemorràgies), la possible aparició d’un quadre conegut com a síndrome de diferenciació (precisament per l’efecte immediat de l’ATRA en la diferenciació dels blastos) i que es caracteritza per un augment de la xifra de leucòcits i una retenció de líquids (que es manifesta per l’aparició d’infiltrats pulmonars, vessaments), així com febre i hipotensió, i el tractament del qual es basa en corticoides i en la interrupció transitòria de l’ATRA. D’altra banda, l’administració d’ATO pot afectar els electròlits de la sang i, per tant, ha d’anar associada a la realització d’analítiques de control per a la seva correcció i evitar alteracions del ritme cardíac.
Generalment, aquest tractament permet assolir la remissió en aproximadament el 80-90 % dels pacients afectes de leucèmia promielocítica aguda. Després de la remissió, es continua amb els cicles de consolidació amb ATRA i ATO en número variable i, posteriorment, es realitza una fase prolongada de tractament de manteniment en la qual no s’acostumen a modificar els fàrmacs utilitzats.
En el cas d’una recidiva, el tractament serà individualitzat per a cada pacient, en funció de la seva edat, estat general i els fàrmacs utilitzats prèviament. És en aquesta situació on pot plantejar-se una estratègia de consolidació que inclogui un trasplantament al·logènic de progenitors hematopoètics, generalment autòleg. El trasplantament al·logènic en la LPA és una indicació molt infreqüent a contemplar en cas que fracassi el trasplantament autòleg, la qual cosa és excepcional.
Amb les noves estratègies de tractament, la supervivència és molt alta, i són molt poc freqüents les recaigudes.
Pacients amb síndrome de Down
Les persones amb síndrome de Down tenen un risc 15 vegades superior a presentar una leucèmia aguda. En el cas de la leucèmia mieloide aguda, l’edat de presentació acostuma a ser infantil o en adults joves.
Aquest grup de pacients presenta una elevada sensibilitat als tractaments quimioteràpics i això ha possibilitat taxes de curació elevades. Una de les principals dificultats per aconseguir la curació es deu a l’elevada toxicitat davant alguns fàrmacs quimioteràpics i l’elevat risc d’infecció. És per aquest motiu que diferents grups han aconseguit augmentar la supervivència amb protocols de tractaments adaptats.
Quines probabilitats tenen de curar-se els pacients adults de leucèmia mieloide aguda?
El pronòstic dels pacients afectats de leucèmia mieloide aguda varia substancialment en funció de diversos factors que inclouen: l’edat, l’antecedent de tractament quimioteràpic previ o el desenvolupament de la LMA en persones amb alteracions hematològiques prèvies com ara la mielodisplàsia o la síndrome mieloproliferativa, el grau de leucocitosi inicial, la presència de determinades anomalies citogenètiques/moleculars, així com la lentitud en l’obtenció de la remissió completa.
D’aquesta forma, els pacients joves amb leucèmies de risc baix (grup favorable) tenen una probabilitat de curació superior al 75 %, mentre que els de risc intermedi que reben un trasplantament al·logènic d’un donant òptim tenen una probabilitat de curació de fins al 65-70 %. Tot i això, un pacient amb leucèmies de molt alt risc, especialment en cas de no assolir la remissió completa amb el tractament quimioteràpic, tenen molt poques opcions de curació.
El cas concret de la leucèmia promielocítica aguda té una estimació del 90 % de taxes de supervivència.
És molt important remarcar que les estadístiques de les taxes de supervivència en el cas de les persones amb leucèmia mieloide aguda són una estimació i en cada cas l’equip mèdic ho valorarà de forma individualitzada.

Sara, 29 anys.
Leucèmia mieloide aguda.
“Amb 17 anys em van diagnosticar una leucèmia mieloide aguda. Va ser un revés enorme. A la meva mare li acabaven de diagnosticar càncer de mama. L’estiu del 2014, em vaig sotmetre al meu trasplantament de medul·la òssia d’un donant no emparentat localitzat pel programa REDMO de la Fundació Josep Carreras, i també van operar la meva mare. Després de 9 anys, encara que amb força limitacions, estic estudiant per ser infermera”.
Seguiment
Després de completar el tractament, és molt important continuar amb els controls periòdics amb el vostre equip mèdic, així com amb altres especialistes en cas necessari. Els controls es realitzaran per confirmar i ajudar en la recuperació física després del tractament i fer un seguiment i identificació precoç de les possibles complicacions a llarg termini. De la mateixa manera, especialment en els primers mesos/anys després de finalitzar el tractament, es realitzaran analítiques i estudis medul·lars per confirmar l’absència de reaparició de la malaltia. Aquests controls es van espaiant progressivament. És recomanable realitzar un seguiment com a mínim anual a llarg termini per poder detectar aviat i poder tractar, si apareguessin, les seqüeles del tractament o de la leucèmia.
Enllaços d'interès sobre temes mèdics relacionats amb la leucèmia mieloide aguda en adults
- Tractament de la leucèmia mieloide aguda en adults. American Cancer Society.
- Subtipus i factors pronòstics de la leucèmia mieloide aguda. American Cancer Society.
- Informació sobre la leucèmia promielocítica aguda. Leukemia and Lymphoma Society
- La leucèmia mieloide aguda en nens i adolescents. Leukemia and Lymphoma Society
- Guia de la leucèmia mieloide aguda en adults. American Society of Clinical Oncology
- Informació sobre la leucèmia mieloide aguda de l’adult. AEAL
- Guia sobre la leucèmia mieloide aguda per a pacients i cuidadors. Leukemia and Lymphoma Society
Enllaços d'interès sobre altres temes relacionats amb la leucèmia limfoblàstica aguda en adults
MATERIALS TESTIMONIALS
Pots sol·licitar-nos els llibrets en format paper per a enviament gratuït a l’Estat espanyol a través del correu electrònic: imparables@fcarreras.es
TRASPLANTAMENT DE MEDUL·LA ÒSSIA
- Guia del Trasplantament de Medul·la Òssia. Fundació Josep Carreras (contingut en espanyol)
- Què és l’HLA i com funciona? Fundació Josep Carreras (contingut en espanyol)
- La Malaltia Empelt contra Receptor. Fundació Josep Carreras (contingut en espanyol)
- Història del Trasplantament de Medul·la Òssia. Fundació Josep Carreras (contingut en espanyol)
- Com es realitza la cerca d’un donant compatible anònim? Fundació Josep Carreras (contingut en espanyol)
ALIMENTACIÓ
- Com mantenir una alimentació saludable durant el tractament? Fundació Josep Carreras (contingut en espanyol)
- Guia de nutrició. Leukemia & Lymphoma Society
ALTRES
- Idees sobre què emportar-me a una cambra d’aïllament. Fundació Josep Carreras contra la leucèmia (contingut en espanyol)
- Consells de viatge per a persones amb càncer. Fundació Josep Carreras contra la leucèmia (contingut en espanyol)
- Manual de fisioteràpia en pacients hematològics i trasplantats. Fundació Josep Carreras contra la leucèmia (contingut en espanyol)
- Prevenció i tractament de la mucositis oral. Fundació Josep Carreras contra la leucèmia (contingut en espanyol)
- La higiene bucodental en el pacient onco-hematològic. Fundació Josep Carreras contra la leucèmia (contingut en espanyol)
- Manual fertilitat: Patir un càncer de la sang i ser pare o mare. Fundació Josep Carreras contra la leucèmia (contingut en espanyol)
- La cura de la pell en el pacient onco-hematològic. Fundació Josep Carreras contra la leucèmia (contingut en espanyol)
- Manual Estètica Oncològica. Fundació Josep Carreras contra la leucèmia (contingut en espanyol)
- Leucèmia i sexualitat. Fundació Josep Carreras contra la leucèmia (contingut en espanyol)
- 7 formes de posar-se un mocador. Fundació Josep Carreras contra la leucèmia (contingut en espanyol)
Enllaços d'interès: entitats locals/provincials o estatals que poden proveir-te de recursos i serveis especialitzats en leucèmia o en pacients oncològics:
A l’Estat espanyol existeix un gran teixit associatiu per a pacients amb càncer hematològic que, en molts casos, pot informar-te, assessorar-te i fins i tot realitzar alguns tràmits. Aquests són els contactes d’algunes associacions per Comunitats Autònomes:
Totes aquestes organitzacions són externes a la Fundació Josep Carreras.
ESTATAL
- CEMMP (Comunidad Española de Pacientes de Mieloma Múltiple)
- AEAL (ASOCIACIÓN ESPAÑOLA DE AFECTADOS POR LINFOMA, MIELOMA y LEUCEMIA)
- AECC (ASOCIACIÓN ESPAÑOLA CONTRA EL CÁNCER). Present a les diferents províncies i a moltes localitats. Contactar amb la seu més propera o trucant al 900 100 036 (24h).
- AELCLES (Agrupación Española contra la Leucemia y Enfermedades de la Sangre)
- FUNDACIÓ JOSEP CARRERAS CONTRA LA LEUCÈMIA
- FUNDACIÓ SANDRA IBARRA
- GEPAC (GRUPO ESPAÑOL DE PACIENTES CON CÁNCER)
- MPN España (Asociación de Afectados Por Neoplasias Mieloproliferativas Crónicas)
ANDALUSIA
- AECC (ASOCIACIÓN ESPAÑOLA CONTRA EL CÁNCER). Present a les diferents províncies i a moltes localitats. Contactar amb la seu més propera.
- ALUSVI (ASOCIACIÓN LUCHA Y SONRÍE POR LA VIDA). Sevilla
- APOLEU (ASOCIACIÓN DE APOYO A PACIENTES Y FAMILIARES DE LEUCEMIA). Cadis
ARAGÓ
- AECC (ASOCIACIÓN ESPAÑOLA CONTRA EL CÁNCER). Present a les diferents províncies i a moltes localitats. Contactar amb la seu més propera.
- ASPHER (ASOCIACIÓN DE PACIENTES DE ENFERMEDADES HEMATOLÓGICAS RARAS DE ARAGÓN)
- DONA MÉDULA ARAGÓN
ASTÚRIES
- AECC (ASOCIACIÓN ESPAÑOLA CONTRA EL CÁNCER). Present a les diferents províncies i a moltes localitats. Contactar amb la seu més propera.
- ASTHEHA (ASOCIACIÓN DE TRASPLANTADOS HEMATOPOYÉTICOS Y ENFERMOS HEMATOLÓGICOS DE ASTURIAS)
CANTÀBRIA
- AECC (ASOCIACIÓN ESPAÑOLA CONTRA EL CÁNCER). Present a les diferents províncies i a moltes localitats. Contactar amb la seu més propera.
CASTELLA-LA MANXA
- AECC (ASOCIACIÓN ESPAÑOLA CONTRA EL CÁNCER). Present a les diferents províncies i a moltes localitats. Contactar amb la seu més propera.
CASTELLA I LLEÓ
- ABACES (ASOCIACIÓN BERCIANA DE AYUDA CONTRA LAS ENFERMEDADES DE LA SANGRE)
- AECC (ASOCIACIÓN ESPAÑOLA CONTRA EL CÁNCER). Present a les diferents províncies i a moltes localitats. Contactar amb la seu més propera.
- ALCLES (ASOCIACIÓN LEONESA CON LAS ENFERMEDADES DE LA SANGRE). Lleó.
- ASCOL (ASOCIACIÓN CONTRA LA LEUCEMIA Y ENFERMEDADES DE LA SANGRE). Salamanca.
CATALUNYA
- ASSOCIACIÓ FÈNIX. Solsona
- FECEC (FEDERACIÓ CATALANA D’ENTITATS CONTRA EL CÀNCER
- FUNDACIÓ KÁLIDA. Barcelona
- FUNDACIÓ ROSES CONTRA EL CÀNCER. Roses
- LLIGA CONTRA EL CÀNCER COMARQUES DE TARRAGONA I TERRES DE L’EBRE. Tarragona
- MielomaCAT
- ONCOLLIGA BARCELONA. Barcelona
- ONCOLLIGA GIRONA. Girona
- ONCOLLIGA COMARQUES DE LLEIDA. Lleida
- ONCOVALLÈS. Vallès Oriental
- OSONA CONTRA EL CÀNCER. Osona
- SUPORT I COMPANYIA. Barcelona
- VILASSAR DE DALT CONTRA EL CÀNCER. Vilassar de Dalt
COMUNITAT VALENCIANA
- AECC (ASOCIACIÓN ESPAÑOLA CONTRA EL CÁNCER). Present a les diferents províncies i a moltes localitats. Contactar amb la seu més propera.
- ASLEUVAL (ASOCIACIÓN DE PACIENTES DE LEUCEMIA, LINFOMA, MIELOMA Y OTRAS ENFERMEDADES DE LA SANGRE DE VALENCIA)
EXTREMADURA
- AECC (ASOCIACIÓN ESPAÑOLA CONTRA EL CÁNCER). Present a les diferents províncies i a moltes localitats. Contactar amb la seu més propera.
- AFAL (AYUDA A FAMILIAS AFECTADAS DE LEUCEMIAS, LINFOMAS; MIELOMAS Y APLASIAS)
- AOEX (ASOCIACIÓN ONCOLÓGICA EXTREMEÑA)
GALÍCIA
- AECC (ASOCIACIÓN ESPAÑOLA CONTRA EL CÁNCER). Present a les diferents províncies i a moltes localitats. Contactar amb la seu més propera.
- ASOTRAME (ASOCIACIÓN GALLEGA DE AFECTADOS POR TRASPLANTES MEDULARES)
ILLES BALEARS
- ADAA (ASSOCIACIÓ D’AJUDA A L’ACOMPANYAMENT DEL MALALT DE LES ILLES BALEARS)
- AECC (ASOCIACIÓN ESPAÑOLA CONTRA EL CÁNCER). Present a les diferents províncies i a moltes localitats. Contactar amb la seu més propera.
ILLES CANÀRIES
- AECC (ASOCIACIÓN ESPAÑOLA CONTRA EL CÁNCER). Present a les diferents províncies i a moltes localitats. Contactar amb la seu més propera.
- AFOL (ASOCIACIÓN DE FAMILIAS ONCOHEMATOLÓGICAS DE LANZAROTE)
- FUNDACIÓ ALEJANDRO DA SILVA
LA RIOJA
- AECC (ASOCIACIÓN ESPAÑOLA CONTRA EL CÁNCER). Present a les diferents províncies i a moltes localitats. Contactar amb la seu més propera.
MADRID
- AECC (ASOCIACIÓN ESPAÑOLA CONTRA EL CÁNCER). Present a les diferents províncies i a moltes localitats. Contactar amb la seu més propera.
- AEAL (ASOCIACIÓN ESPAÑOLA DE LEUCEMIA Y LINFOMA)
- CRIS CONTRA EL CÁNCER
- FUNDACIÓN LEUCEMIA Y LINFOMA
MÚRCIA
- AECC (ASOCIACIÓN ESPAÑOLA CONTRA EL CÁNCER). Present a les diferents províncies i a moltes localitats. Contactar amb la seu més propera.
NAVARRA
- AECC (ASOCIACIÓN ESPAÑOLA CONTRA EL CÁNCER). Present a les diferents províncies i a moltes localitats. Contactar amb la seu més propera.
PAÍS BASC
- AECC (ASOCIACIÓN ESPAÑOLA CONTRA EL CÁNCER). Present a les diferents províncies i a moltes localitats. Contactar amb la seu més propera.
- PAUSOZ-PAUSO. Bilbao
CIUTATS AUTÒNOMES DE CEUTA I MELILLA
- AECC CEUTA (ASOCIACIÓN ESPAÑOLA CONTRA EL CÁNCER)
- AECC MELILLA (ASOCIACIÓN ESPAÑOLA CONTRA EL CÁNCER)
Suport i ajuda
Et convidem també a seguir-nos a través de les nostres xarxes socials principals (Facebook, Twitter i Instagram) on sovint compartim testimonis de superació.
Si resideixes a l’Estat espanyol, també pots posar-te en contacte amb nosaltres enviant-nos un correu electrònic a imparables@fcarreras.es perquè t’ajudem a posar-te en contacte amb altres famílies que han superat aquesta malaltia.
* D’acord amb la Llei 34/2002 de Serveis de la Societat de la Informació i el Comerç Electrònic (LSSICE), la Fundació Josep Carreras contra la Leucèmia informa que tota la informació mèdica disponible a www.fcarreras.org ha estat revisada i acreditada pel Dr. Enric Carreras Pons, Col·legiat núm. 9438, Barcelona, Doctor en Medicina i Cirurgia, Especialista en Medicina Interna, Especialista en Hematologia i Hemoteràpia i Consultor sènior de la Fundació; i per la Dra. Rocío Parody Porras, Col·legiada núm. 35205, Barcelona, Doctora en Medicina i Cirurgia, Especialista en Hematologia i Hemoteràpia i adscrita a la Direcció mèdica del Registre de Donants de Medul·la Òssia (REDMO) de la Fundació).
Informació revisada al novembre de 2023.


