El limfoma de Hodgkin en nens i adolescents
La informació proporcionada a www.fcarreras.org serveix per donar suport, no reemplaçar-la, a la relació que existeix entre els pacients/visitants d’aquest lloc web i del seu metge.
Victoria
Limfoma de Hodgkin.
“Sóc la Victoria. Quan tenia 11 anys em van diagnosticar un limfoma de Hodgkin. El tractament va ser dur, però sempre vaig estar somrient. Volia dir-vos que un mateix se’n surt, que he guanyat la batalla i que estic bé”.
Informació revisada per la Dra. Rocío Parody Porras, Metgessa especialista en Hematologia. Membre de la Direcció de REDMO (Sociedad Española de Hematología i Hemoterapia) i de l’equip mèdic de la Fundació. Col·legi de Metges de Barcelona (Col. 35.205)
Què és el limfoma de Hodgkin en nens i adolescents i a qui afecta?
El limfoma de Hodgkin es presenta amb més freqüència en la infància i en adolescents de 15 a 19 anys. El tractament dels nens i els adolescents és diferent al dels adults. Vegeu limfoma de Hodgkin en adults
A diferència dels limfomes no hodgkinians, en els quals existeixen més de 60 subtipus de presentació clínica i curs completament diferent, l’última classificació de l’Organització Mundial de la Salut divideix el limfoma de Hodgkin en dos principals subtipus: el limfoma de Hodgkin clàssic i el limfoma de Hodgkin de predomini limfocític nodular.
- El limfoma de Hodgkin clàssic
Aquest és el tipus més comú de limfoma de Hodgkin i constitueix el 95 % de tots els limfomes de Hodgkin. Es presenta amb més freqüència en els adolescents. Quan s’analitza una mostra de teixit de gangli limfàtic en el microscopi, s’observen les cèl·lules del limfoma de Hodgkin, anomenades cèl·lules de Reed-Sternberg. Aquestes cèl·lules són realment limfòcits grans i anormals que, de vegades, contenen més d’un nucli cel·lular. Aquestes cèl·lules característiques expressen dos antígens de membrana, el CD30 i el CD15. L’expressió del CD30 té importància a l’hora de considerar el tractament de la malaltia amb anticossos monoclonals específics.
El limfoma de Hodgkin clàssic pot dividir-se en 4 subtipus diferents i, així mateix, cadascun en 4 estadis diferents. Vegem primer els diferents subtipus:
- El limfoma de Hodgkin amb esclerosi nodular. Aquest és el subtipus més freqüent (80 % dels diagnòstics de limfoma de Hodgkin clàssic) i es presenta amb més freqüència en nens grans, en adolescents i adults joves. És comú que la malaltia afecti aquests pacients en els ganglis limfàtics del mediastí (centre del pit). Per això, sovint es presenta una massa en el tòrax en el moment del diagnòstic.
- El limfoma de Hodgkin amb cel·lularitat mixta. Aquest subtipus acostuma a presentar-se en nens més petits, amb freqüència en nens de menys de 10 anys. Es relaciona amb antecedents d’infecció pel virus d’Epstein-Barr (VEB, també conegut com a virus de l’herpes humà 4) i sovint es troba en el diagnòstic en els ganglis limfàtics del coll.
- El limfoma de Hodgkin clàssic ric en limfòcits. Aquest subtipus és poc freqüent en nens. Quan s’observa una mostra de teixit de gangli limfàtic en el microscopi, es troben cèl·lules de Reed-Sternberg, molts limfòcits normals i altres cèl·lules sanguínies.
- El limfoma de Hodgkin amb depleció limfocítica. També és un subtipus poc freqüent en nens i es presenta més freqüentment en adults i/o en adults amb el virus de la immunodeficiència humana (VIH). Quan s’observa una mostra de teixit de gangli limfàtic en el microscopi, es distingeixen moltes cèl·lules canceroses grans amb forma estranya, pocs limfòcits normals, i altres cèl·lules sanguínies.
- El limfoma de Hodgkin amb predomini limfocític nodular
Aquest tipus de limfoma de Hodgkin és infreqüent (menys del 5 % de tots els diagnòstics de limfoma de Hodgkin). A la infància, es presenta en nens més grans. En observar el teixit limfàtic afectat en el microscopi, les cèl·lules canceroses tenen una forma molt particular, com de “crispetes”. Aquestes cèl·lules no expressen l’antigen CD30 ni el CD15, però sí expressen el CD20. Aquest tipus de limfoma sovint es diagnostica després de l’inflament d’un gangli limfàtic en el coll, axil·la o engonal. Aquest tipus de limfoma de Hodgkin té un pronòstic i una evolució molt diferents al limfoma de Hodgkin clàssic.
Tal com hem dit anteriorment, el limfoma de Hodgkin es classifica també en estadis que permeten saber als hematòlegs l’àmbit d’extensió o afectació de les cèl·lules canceroses. És a dir, és necessari conèixer la quantitat de malaltia que el pacient té en el moment del diagnòstic. És una eina de diagnòstic important, ja que després es tradueix en una tria de la intensitat de tractament. S’anomena classificació d’Ann-Arbor.
- Estadi 1: el limfoma afecta una sola regió ganglionar o afecta un únic òrgan fora del sistema limfàtic.
- Estadi 2: existeixen dues o més regions ganglionars afectades en el mateix costat del diafragma.
- Estadi 3: hi ha diverses regions ganglionars afectades a ambdós costats del diafragma.
- Estadi 4: hi ha un o més territoris extraganglionars (medul·la òssia, fetge, pulmons) afectats.
L’estadi de la classificació d’Ann Arbor s’acompanya de les lletres A, B, E o S:
- No existeixen símptomes B al diagnòstic (febre, pèrdua de pes significativa, suors nocturnes).
- Existeixen símptomes B.
- Existeix afectació d’una regió extraganglionar per contigüitat a partir de l’afectació d’un gangli o paquet de ganglis.
- Existeix afectació a nivell de la melsa.
Totes aquestes classificacions permeten dilucidar el grup de risc del limfoma diagnosticat i, d’aquesta forma, proposar el tractament més indicat.
Quines són les causes del limfoma de Hodgkin?
 Avui dia es desconeixen les causes del limfoma de Hodgkin. En principi, no es tracta d’una malaltia infecciosa ni hereditària, no existeixen factors mediambientals que estiguin clarament relacionats amb el seu desenvolupament i, tot i que en alguns casos es pot detectar la presència del virus d’Epstein-Barr, no es coneix bé actualment quina és la relació causal entre el virus i el desenvolupament de la malaltia, tot i que nombrosos grups d’investigació es dediquen a intentar dilucidar aquesta relació.
Avui dia es desconeixen les causes del limfoma de Hodgkin. En principi, no es tracta d’una malaltia infecciosa ni hereditària, no existeixen factors mediambientals que estiguin clarament relacionats amb el seu desenvolupament i, tot i que en alguns casos es pot detectar la presència del virus d’Epstein-Barr, no es coneix bé actualment quina és la relació causal entre el virus i el desenvolupament de la malaltia, tot i que nombrosos grups d’investigació es dediquen a intentar dilucidar aquesta relació.
Segons el National Cancer Institute dels Estats Units, “és possible que la infecció pel virus d’Epstein-Barr i els antecedents familiars de limfoma de Hodgkin augmentin el risc de limfoma de Hodgkin infantil”. És el que es denomina “factors de risc”, tot i que de cap manera significa que la persona emmalaltirà de càncer.
Els factors de risc per al limfoma de Hodgkin són els següents:
- Estar infectat pel virus d’Epstein-Barr (VEB).
- Tenir antecedents personals de mononucleosi.
- Estar infectat pel virus de la immunodeficiència humana (VIH).
- Tenir determinades malalties del sistema immunitari, com ara la síndrome limfoproliferativa autoimmunitària.
- Tenir un sistema immunitari debilitat després d’un trasplantament d’òrgan o per un medicament que es va administrar per detenir el rebuig de l’òrgan per part del cos.
- Tenir un pare, un germà o germana amb antecedents personals de limfoma de Hodgkin.
Quins són els símptomes del limfoma de Hodgkin?
En la majoria dels casos, els pacients no presenten cap símptoma en el moment del diagnòstic (60-70 % dels casos). La causa més freqüent de consulta al metge és l’aparició d’un gangli limfàtic augmentat de mida. Aquests ganglis es troben localitzats preferentment a la regió cervical (moltes vegades es confonen amb ganglis inflamats secundaris a infeccions bucals, dentàries o d’oïdes). A vegades aquests ganglis augmentats de mida es localitzen en la regió axil·lar o inguinal. Moltes vegades, els pacients acudeixen al metge per tos seca persistent, i a la radiografia del tòrax s’observa una massa a nivell de mediastí (regió localitzada entre els dos pulmons). De manera menys freqüent, el pacient té dolor abdominal a causa del creixement de la melsa. Només en el 25-30 % dels casos, el pacient presenta els anomenats símptomes B (pèrdua de pes superior al 10 % en els darrers sis mesos sense causa determinada, febre vespertina i sudoració nocturna). De vegades, els pacients poden presentar picors cutànies generalitzades i lesions de rascat de diversos mesos d’evolució abans del diagnòstic de la malaltia (10-15 % dels pacients).
Alguns d’aquests símptomes poden ser:
Ganglis limfàtics inflamats no dolorosos prop de la clavícula, en el coll, el tòrax, les axil·les o l’engonal.
- Febre sense raó coneguda.
- Pèrdua de pes i/o de la gana sense motiu
- Suors nocturnes excessives.
- Sentir-se molt cansat.
- Picor a la pell.
- Tos.
- Dificultat per respirar, sobretot en estar estirat.
Quan hi ha febre, pèrdua de pes sense motiu i suors nocturnes excessives, és el que es coneix com a símptomes B. La seva presència o no en el diagnòstic és important per poder classificar bé el limfoma.
Com es diagnostica el limfoma de Hodgkin?
El diagnòstic del limfoma de Hodgkin s’ha de realitzar mitjançant:
- examen físic i antecedents de salut
- analítica sanguínia (hemograma i bioquímica)
- prova d’imatge per detectar la presència de ganglis patològics o altres àrees afectes (en el moment actual, la prova a utilitzar és la tomografia per emissió de positrons associada a una tomografia axial computaritzada – PET/TAC) i, en aquells casos en què la PET/TAC és negativa, ja no es recomana realitzar una biòpsia de medul·la òssia.
- la biòpsia d’un gangli limfàtic sospitós. La punció aspiració d’un gangli limfàtic inflamat, estratègia molt freqüentment utilitzada per al diagnòstic dels tumors sòlids en oncologia mèdica, no és una tècnica vàlida per al diagnòstic dels limfomes en general perquè no permet veure l’estructura del gangli en el microscopi. En alguns casos es pot utilitzar la biòpsia amb agulla gruixuda.
Quin és el tractament del limfoma de Hodgkin?
 Abans de valorar el tractament més adequat, el diagnòstic ha de ser precís i el nen o adolescent ha de ser tractat per un equip mèdic amb experiència en càncer infantil.
Abans de valorar el tractament més adequat, el diagnòstic ha de ser precís i el nen o adolescent ha de ser tractat per un equip mèdic amb experiència en càncer infantil.
El limfoma de Hodgkin és el càncer hematològic que amb més freqüència podem curar en el moment actual. En els darrers anys hem estat capaços de millorar de manera significativa la supervivència a llarg termini dels pacients, sobretot dels pacients més joves. En general, el tractament del limfoma de Hodgkin està basat en la utilització de poliquimioteràpia de vegades associada a radioteràpia sobre la zona afectada, quimioteràpia a altes dosis amb trasplantament autòleg de progenitors hematopoètics i, actualment, disposem també dels anomenats “nous fàrmacs” per al tractament d’aquesta malaltia.

Tractament de primera línia
L’esquema quimioteràpic de primera línia, considerat com a estàndard, és el denominat ABVD (per les sigles de la combinació de fàrmacs: adriamicina, bleomicina, vinblastina i dacarbacina). La quimioteràpia ABVD s’administra per via endovenosa de manera ambulatòria en la majoria dels pacients, el cicle es repeteix cada 28 dies amb dues administracions, una en el dia 1 i la segona en el dia 14. En pacients diagnosticats en estadis inicials sense factors de mal pronòstic, el tractament recomanat és l’administració de dos cicles d’ABVD i radioteràpia complementària sobre les zones afectades (20 Gys). En pacients diagnosticats en estadis inicials, però amb factors de mal pronòstic, es recomana l’administració de quatre cicles d’ABVD i radioteràpia complementària (30 Gys). El tractament dels pacients en estadis avançats suposa l’administració de sis cicles d’ABVD. Si la PET/TAC en finalitzar la quimioteràpia és negativa, no és necessària en general l’administració de radioteràpia complementària. Existeixen altres esquemes de quimioteràpia més intensius, més eficaços per controlar la malaltia, però també més tòxics que no són molt utilitzats en el nostre país (per exemple, BEACOPP escalat).
Tractament de segona línia i posteriors.
Malgrat que els resultats del tractament de primera línia són molt bons, hi ha un 5-15 % dels pacients que són primàriament refractaris (que no responen al tractament de primera línia) i un 30 % de pacients que, després d’aconseguir una remissió completa, recauen de la seva malaltia. Aquests pacients són tractats amb esquemes de quimioteràpia de segona línia. Aquests tractaments són més intensius que els de primera i, sobretot, utilitzen fàrmacs diferents als inclosos dins del tractament de primera línia. Si el pacient aconsegueix una resposta està indicat consolidar-la amb quimioteràpia a dosis altes i trasplantament autòleg de progenitors hematopoètics. Els pacients que recauen després del trasplantament autòleg tenen pitjor pronòstic. Fins fa relativament poc temps, els pacients que requeien després d’un trasplantament autòleg podien ser candidats a rebre un trasplantament al·logènic de progenitors hematopoètics a partir d’un germà idèntic, un donant no emparentat compatible i, més recentment, a partir d’un donant familiar haploidèntic.
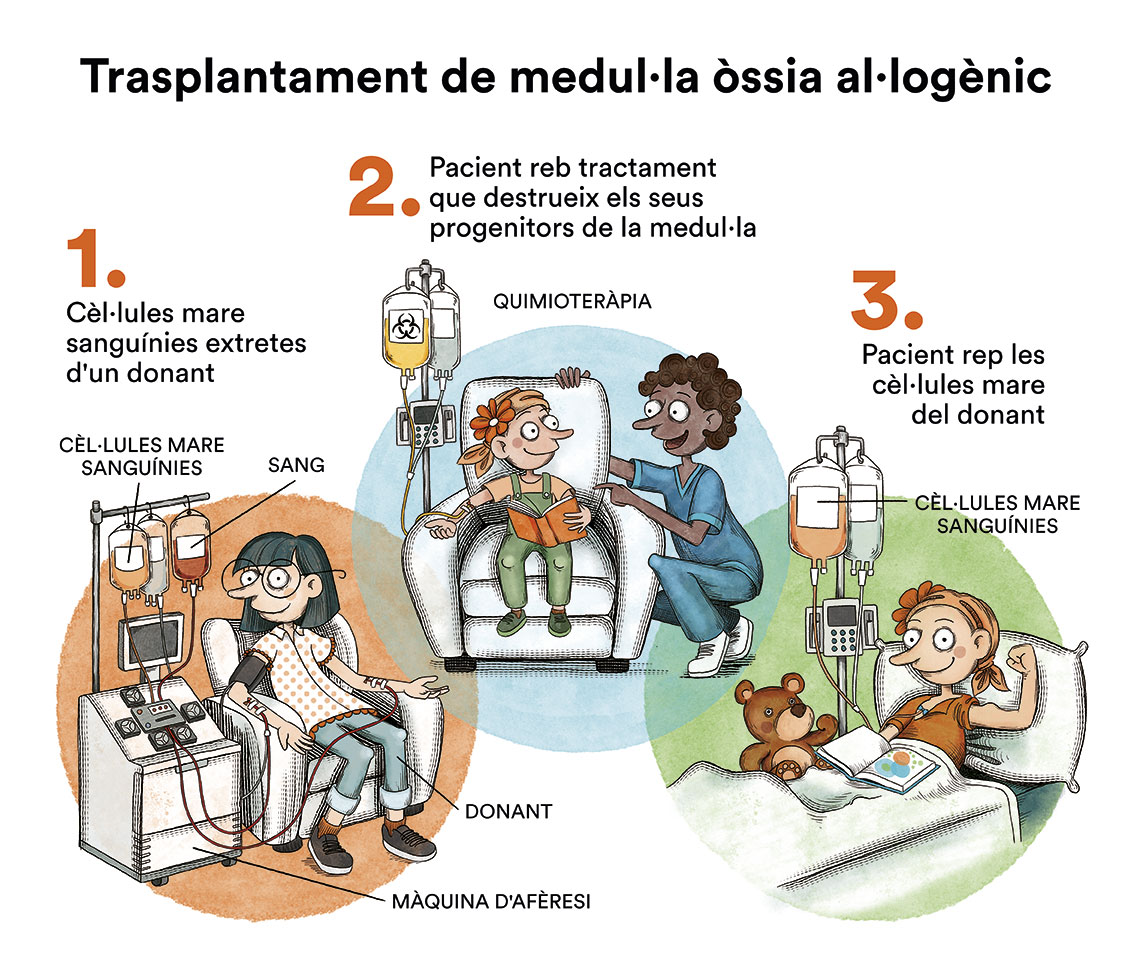
Actualment disposem de “nous fàrmacs”, o teràpies dirigides, en el tractament del limfoma de Hodgkin que, en el moment actual, estan indicats en pacients que estan en recaiguda o són refractaris al tractament previ.
- Anticossos monoclonals:
Els anticossos monoclonals són proteïnes del sistema immunitari però produïdes en el laboratori. Aquests anticossos s’adhereixen a algunes dianes específiques que tenen les cèl·lules canceroses o a altres cèl·lules que ajuden a que es formin les cèl·lules malignes. Aquests anticossos monoclonals destrueixen les cèl·lules canceroses, les bloquegen o impedeixen que es disseminin. Aquests anticossos s’infonen al pacient. Això significa que s’empelten al torrent sanguini per un catèter.
Un d’aquests anticossos monoclonals utilitzats per als pacients de limfoma de Hodgkin en recaiguda o refractaris al tractament inicial és el brentuximab vedotina, un anticòs monoclonal anti CD-30 que ha demostrat ser molt efectiu i tenir un perfil de toxicitat molt acceptable en pacients en recaiguda o refractaris després d’un trasplantament autòleg o en pacients que han fracassat a dues línies diferents de quimioteràpia i no són candidats a un trasplantament autòleg de progenitors hematopoètics.
- Inhibidors de checkpoint:
El segon grup de nous fàrmacs que estem utilitzant en el moment actual en el tractament d’aquests pacient són els inhibidors de checkpoint (inhibidors de punts de control immunitari) que estan indicats en el moment actual en pacients que recauen després d’un trasplantament autòleg i que fracassen també al tractament amb brentuximab vedotina. Nivolumab i pembrolizumab són fàrmacs inhibidors de checkpoint molt efectius i ben tolerats per la majoria dels pacients. Els inhibidors de checkpoint són fàrmacs que ajuden a les mateixes cèl·lules del cos a atacar el càncer. Els inhibidors de checkpoint són un tipus d’ immunoteràpia (teràpies en què s’utilitza el sistema immunitari del cos per combatre el càncer).
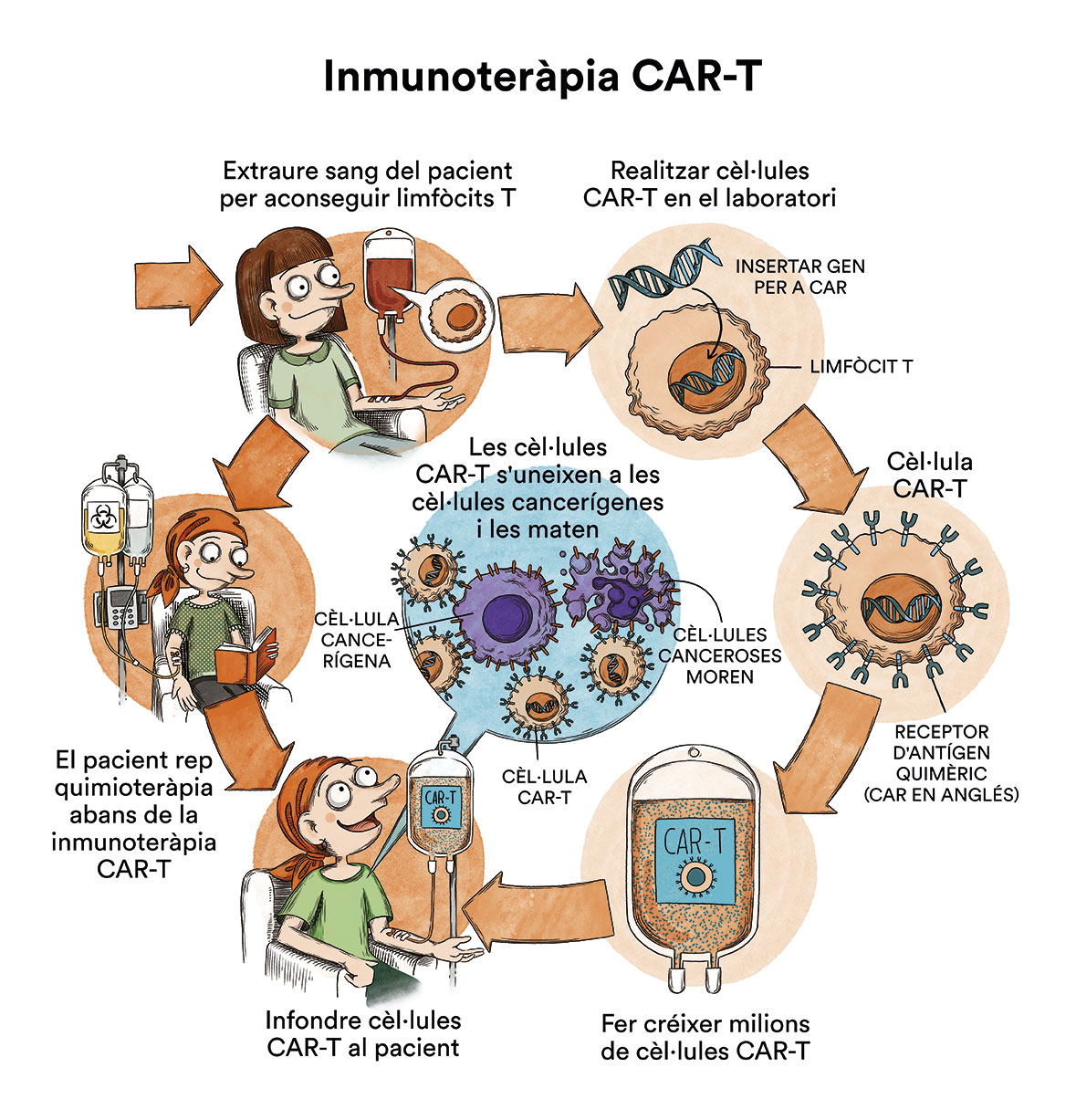
- Alguns tractaments són estàndard i altres s’estan provant en assajos clínics. Un assaig clínic d’un tractament és un estudi d’investigació amb l’objectiu de millorar els tractaments actuals o obtenir informació sobre tractaments nous per als pacients de càncer. Actualment s’estan duent a terme en el món diversos assajos clínics d’immunoteràpies CAR-T anti CD-30 (proteïna que expressen les cèl·lules cancerígenes de molts tipus de limfoma de Hodgkin) per a pacients que han esgotat totes les possibilitats terapèutiques en cartera sanitària.
Quines probabilitats tenen de curar-se els nens i adolescents amb limfoma de Hodgkin?
Com en qualsevol malaltia neoplàstica, el seu pronòstic dependrà del tipus histològic de limfoma de Hodgkin, de la seva extensió i de la resposta al tractament. Si no existeixen factors adversos, i han estat correctament tractats, la possibilitat de curació d’aquests pacients és superior al 80 %.
Malgrat el bon pronòstic generalitzat dels pacients amb limfoma de Hodgkin, els malalts que no aconsegueixen una remissió completa després del tractament inicial o els pacients amb recidives tardanes tenen un pronòstic molt més desfavorable.
Enllaços d'interès sobre temes mèdics relacionats amb el limfoma de Hodgkin en nens i adolescents
- Tractament de limfoma de Hodgkin infantil. National Cancer Institute
- El limfoma en nens. St Jude CHildren’s Research Center
- Tractament del limfoma de Hodgkin en nens. American Cancer Society
Enllaços d’interès: entitats locals (recursos i serveis)
Totes aquestes organitzacions són externes a la Fundació Josep Carreras.
ANDALUSIA
ARAGÓ
ASTÚRIES
CASTELLA-LA MANXA
CASTELLA I LLEÓ
CATALUNYA
COMUNITAT VALENCIANA
EXTREMADURA
GALÍCIA
ILLES BALEARS
ILLES CANÀRIES
LA RIOJA
MADRID
- AAA (asociación de adolescentes y Adultos Jóvenes con Cáncer)
- ASION
- FUNDACIÓN CAICO
- FUNDACIÓN ALADINA
- FUNDACIÓN UNOENTRECIENMIL
MÚRCIA
NAVARRA
PAÍS BASC
Suport i ajuda
Et convidem també a seguir-nos a través de les nostres xarxes socials principals (Facebook, Twitter i Instagram) on sovint compartim testimonis de superació.
Si resideixes a l’Estat espanyol, també pots posar-te en contacte amb nosaltres enviant-nos un correu electrònic a imparables@fcarreras.es perquè t’ajudem a posar-te en contacte amb altres famílies que han superat aquesta malaltia.
* D’acord amb la Llei 34/2002 de Serveis de la Societat de la Informació i el Comerç Electrònic (LSSICE), la Fundació Josep Carreras contra la Leucèmia informa que tota la informació mèdica disponible a www.fcarreras.org ha estat revisada i acreditada pel Dr. Enric Carreras Pons, Col·legiat núm. 9438, Barcelona, Doctor en Medicina i Cirurgia, Especialista en Medicina Interna, Especialista en Hematologia i Hemoteràpia i Consultor sènior de la Fundació; i per la Dra. Rocío Parody Porras, Col·legiada núm. 35205, Barcelona, Doctora en Medicina i Cirurgia, Especialista en Hematologia i Hemoteràpia i adscrita a la Direcció mèdica del Registre de Donants de Medul·la Òssia (REDMO) de la Fundació).
Informació revisada al novembre de 2023.
Fes-te soci/sòcia de la curació de la leucèmia!


