El mieloma múltiple
La información proporcionada en www.fcarreras.org sirve para apoyar, no reemplazar, la relación que existe entre los pacientes/visitantes de este sitio web y su médico.

Santi, 52 años
Mieloma múltiple.
“En abril de 2021 me detectaron un mieloma múltiple después de más de un año con anemia persistente. El diagnóstico de un cáncer incurable, y por tanto crónico, como es el mieloma múltiple, es como un jarro de agua helada que te cae encima de repente. Uno no es capaz de imaginar que algún día le tocará la lotería de tener un cáncer. Es difícil asimilar en la mente toda la información que vas recibiendo por parte de los médicos.
Son días oscuros, con angustia, miedo, tristeza, también rabia contra todo y contra todos, incomprensión, inquietudes, … El futuro tal y como lo conocemos hasta ahora desaparece. Toca pasar pues por el tratamiento inicial (combinación de medicamentos durante 6/7 meses, aféresis y auto trasplante medular). Cada fase con necesidades y problemáticas diferentes. Aprendes a centrarte en cada etapa, en cada día, porque las situaciones son cambiantes. Es evidente que todo en conjunto te limita la vida, tanto la personal como la laboral y como no, la familiar. Toca pues adaptarse a esta situación nueva, reinventarse ya que el Santi de antes del mieloma múltiple ya no volverá y hay que abrazar al nuevo. Me gustaría acabar con una frase que me gusta mucho y que me da mucha fuerza: uno no sabe lo fuerte que puede llegar a ser, cuando ser fuerte es la única opción que tiene”.
Información avalada por ![]()
Información revisada por el Dr. Albert Oriol. Miembro del Servicio de Hematología del Instituto Catalán de Oncología – Badalona. Investigador del Instituto de Investigación contra la Leucemia Josep Carreras. Colegio de Médicos de Barcelona (Co. 26696).
¿Cómo funciona la médula ósea y cuáles son los tipos de células sanguíneas?
El mieloma múltiple (MM) es un tipo de cáncer de las células de la sangre que se origina en la médula ósea. Ver apartado Leucemia, médula ósea y células sanguíneas.
¿Qué es el mieloma múltiple y a quién afecta?
El mieloma múltiple es una enfermedad de la médula ósea, en concreto de las células plasmáticas, como el resto de gammapatías nonoclonales.
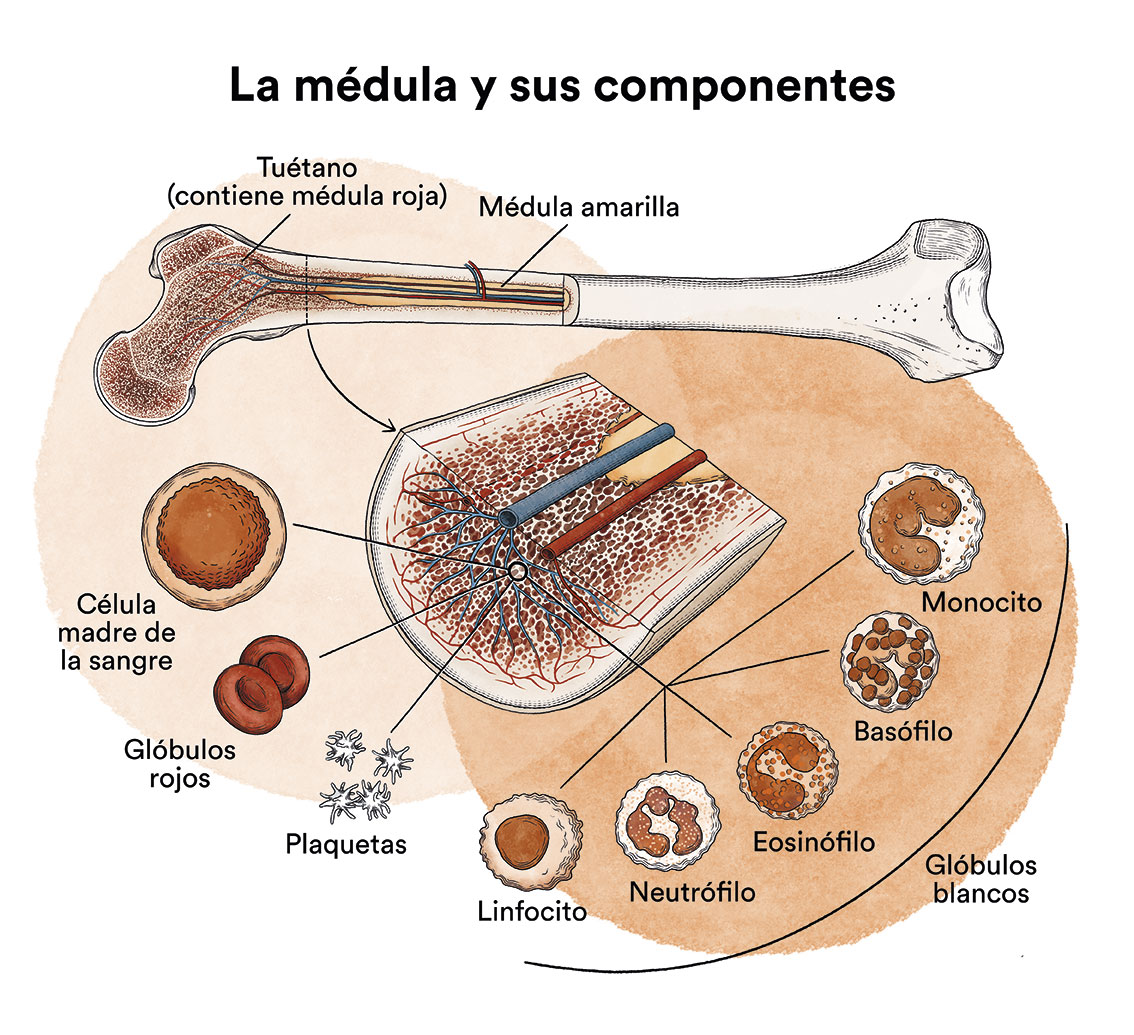
Las células plasmáticas normales forman parte del sistema inmunológico o de defensa del organismo, son las encargadas de fabricar las inmunoglobulinas, unas proteínas capaces de atacar a gérmenes ante una infección. En condiciones normales, las células plasmáticas maduras fabrican durante toda su existencia un único tipo de inmunoglobulina y no se reproducen.
Determinadas alteraciones genéticas pueden hacer que las células plasmáticas recuperen la capacidad de reproducirse y ocupar parcialmente la médula ósea. Esta situación no siempre produce trastornos clínicos, cuando este proceso es asintomático, hablamos de gammapatia monoclonal de significado incierto (GMSI) o de mieloma quiescente (MMq). Las personas en las que se detecta una GMSI o un MMq no requieren tratamiento, pero sí que han de sercontrolados periódicamente, puesto que existe el riesgo de que acaben desarrollando un mieloma múltiple (MM) activo.
En Europa, se diagnostican aproximadamente 40 nuevos casos de MM por cada millón de habitantes y año. En España ello supone unos 3.000 nuevos diagnósticos cada año. El mieloma aparece característicamente en gente mayor, más de la mitad de los pacientes se diagnostican más allá de los 65 o 70 años, aunque puede afectar también a adultos jóvenes.
¿Cuáles son las causas del mieloma múltiple?
No existe ningún factor conocido que sea causa directa de la aparición del mieloma múltiple. Factores que aumentan el riesgo de otras neoplasias como las radiaciones, los virus, el tabaco o el alcohol no parece que tengan ninguna relación con esta enfermedad. Los precursores de las células plasmáticas sufren alteraciones genéticas programadas en el ganglio, durante su proceso de “especialización”, posiblemente, errores en estos cambios genéticos están en el origen del desarrollo de familias de células plasmáticas anómalas que se instalarán en la médula ósea más a delante. Por el momento, no se ha identificado ningún virus o elemento tóxico que facilite estas mutaciones genéticas erróneas y tampoco sabemos por qué en algunas personas, estas alteraciones llevan al desarrollo de una GMSI solamente que nunca progresará a mieloma, mientras que, en otras, el paso de GMSI a MM es muy rápido.
El mieloma múltiple no es contagioso.
¿Cuáles son los síntomas del mieloma múltiple?
La frecuencia con laA que nos hacemos análisis de rutina en la actualidad hace que cada vez sea más habitual diagnosticar un mieloma múltiple (MM) cuando todavía es asintomático, por ejemplo, durante los controles de una GMSI detectada casualmente.
El síntoma más frecuente del mieloma múltiple (MM) es el dolor óseo, sobre todo en la columna vertebral, costillas y caderas. El MM provoca lesiones en los huesos llamadas “lesiones líticas”, zonas del hueso que pierden su contenido en calcio y se debilitan. Estas lesiones suelen ser muy dolorosas y si son suficientemente importantes pueden provocar también una fractura del hueso afectado, lo cual se percibe como un dolor intenso de aparición brusca. A veces el primer síntoma del mieloma es un aplastamiento vertebral al levantar un peso no especialmente grande o una fractura después de un golpe banal.
El segundo síntoma más frecuente en el mieloma múltiple es la anemia. Las células del mieloma invaden la médula ósea y fabrican substancias que impiden la fabricación normal de glóbulos rojos, esto produce anemia que se percibe habitualmente como cansancio, falta de energía y fatigabilidad en esfuerzos cada vez menores. La anemia también puede sospecharse por palidez de la piel, de las uñas o la conjuntiva ocular.
Aunque el dolor y la anemia son los dos síntomas más frecuentes del mieloma múltiple, hay que tener en cuenta que el dolor y la fatigabilidad son dos síntomas muy comunes en una gran variedad de enfermedades incluyendo infecciones víricas y bacterianas o enfermedades reumáticas. En personas de edad avanzada, el motivo más frecuente de dolor óseo son los trastornos degenerativos, principalmente la artrosis y las causas más frecuentes de fatigabilidad son los problemas cardíacos o respiratorios, todos ellos mucho más frecuentes que el mieloma múltiple.
En todo caso, ante problemas de dolor difíciles de controlar con analgésicos o ante una fatigabilidad persistente que aumenta con el tiempo es importante hacer un análisis general incluyendo una determinación de proteínas. En más del 95% de los casos de mieloma múltiple es fácil observar proteínas anómalas en sangre o en orina (lo que se conoce como el componente o banda monoclonal) que servirá a la vez para orientar el diagnóstico y para hacer un seguimiento de la respuesta al tratamiento.
Otros síntomas aparecen con menos frecuencia, pero son muy importantes porque pueden requerir tratamiento específico y nos deben empujar a sospechar rápidamente un mieloma múltiple e instaurar un tratamiento adecuado. Los dos principales son la hipercalcemia, aumento del calcio en sangre, que presentan un 13% de los pacientes al diagnóstico, o la insuficiencia renal que está presente en un 19% de pacientes. La insuficiencia renal y la hipercalcemia se detectan en análisis de sangre básicos. Sus manifestaciones clínicas son poco específicas, falta de apetito, somnolencia, falta de energía o estreñimiento, pero pueden producir síntomas más alarmantes como náuseas y vómitos o somnolencia que puede llegar al estupor y al coma. En estos casos lo habitual es buscar atención urgente. En un análisis básico de urgencias se identificará el problema con facilidad. Tanto la insuficiencia renal como la hipercalcemia requieren de tratamiento inmediato, aunque el MM no esté diagnosticado todavía.
Es muy raro que el mieloma provoque fiebre, aunque es muy frecuente que el mieloma se diagnostique a la vez que una infección. De hecho, es importante sospechar un trastorno de la inmunidad en general en una persona que ha padecido más de una infección grave en pocos meses, sobre todo si no tiene ninguna enfermedad conocida que lo justifique.
El mieloma también puede manifestarse como un bulto o tumor de consistencia dura que normalmente crece a partir de una zona de hueso como el cráneo, una costilla o el esternón. Cuando estas masas se originan en las vértebras no suelen ser visibles o palpables ya que suelen crecer hacia el interior, pero pueden provocar la compresión de la médula espinal o las raíces de los nervios que salen de ella. Esto da manifestaciones graves, como la pérdida de fuerza o de sensibilidad de las piernas o la pérdida de control de los esfínteres (retención de orina). Estas manifestaciones son relativamente poco frecuentes, pero si se dan hay que buscar atención médica urgente.
Otras veces el MM puede tardar en diagnosticarse, sobre todo porque con frecuencia los síntomas iniciales son poco alarmantes o son fácilmente atribuibles a otras causas (dolor de espalda, cansancio,…). Sin embargo, es importante sospechar la presencia de un mieloma ante un dolor que no se controla con tratamientos analgésicos habituales. Un aplastamiento vertebral por ejemplo, aunque se produzca en una persona mayor, debe llevar a realizar un estudio básico incluyendo al menos una analítica básica y pruebas radiológicas. Si en el análisis sanguíneo hay anemia, proteínas por encima de los niveles normales, alteración de la función renal o aumento del calcio en sangre el MM debe sospecharse siempre. También debe sospecharse un MM si las radiografías demuestran “lesiones líticas” típicas de la enfermedad o fracturas no causadas por un traumatismo previo.

Joan
Mieloma múltiple.
“En octubre de 2013 ingresé de urgencias con una insuficiencia renal severa, deshidratación, fiebre, … Alos pocos días me diagnosticaron mieloma múltiple. Nunca había oído ese nombre, pero sí la palabra quimio. En ese momento, como a todos, se me vino el mundo encima y lloré. En agosto del año siguiente, por fin llegó el autotrasplante que fue un éxito y aquí estoy… con mis secuelas, infecciones varias…pero con ganas de vivir y agradecer esta oportunidad brindada”.
¿Cómo se diagnostica el mieloma múltiple?
Cuando existe la sospecha, el diagnóstico de mieloma múltiple es relativamente sencillo. Deben realizarse dos pruebas esenciales:
- Un análisis completo de proteínas en sangre y en orina que permita caracterizar correctamente el componente monoclonal
- Un mielograma o aspirado de médula ósea para confirmar la presencia de células plasmáticas anormales en la médula ósea. En este aspirado medular hay que obtener un número de células suficiente para realizar estudios genéticos (hay alteraciones genéticas de peor pronóstico que interesa detectar) y estudios de citometría de flujo (para identificar características de las células del mieloma que faciliten el seguimiento de la enfermedad residual tras el tratamiento.
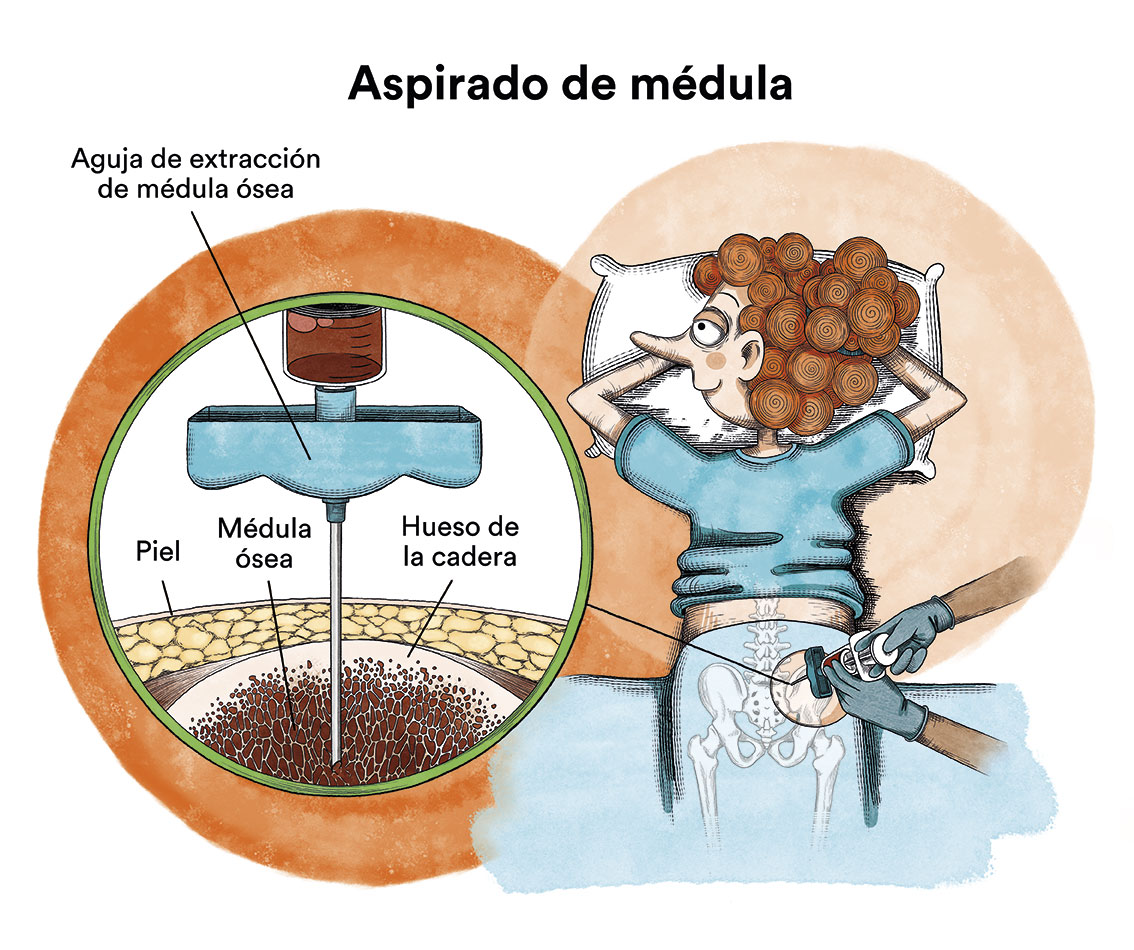
Además, es importante completar el diagnóstico con otras pruebas importantes para determinar el pronóstico y dirigir la actitud terapéutica, que son básicamente pruebas de imagen:
Hay que determinar bien el número y localización de las lesiones óseas mediante un estudio radiológico de todo el esqueleto. La tomografía (TC) permite ver lesiones en zonas donde la radiografía simple es poco sensible, la resonancia magnética permite evaluar mejor la columna vertebral y es especialmente útil si se sospecha compresión medular o masas de mieloma (plasmocitomas) junto a las vértebras y la tomografía de emisión de positrones (PET-TC) que puede detectar lesiones en otras localizaciones, aunque no siempre es necesario hacer todas estas pruebas.
El mieloma es una enfermedad diseminada que afecta a todo el esqueleto. Por tanto, a diferencia de otros cánceres, el estadiaje (basado en variables como la cantidad de componente monoclonal en sangre y en orina, lesiones óseas, presencia de anemia y nivel de calcio en sangre), no sirve para distinguir enfermedad localizada de enfermedad diseminada. La medición de dos parámetros en sangre (albúmina y beta2-microglobulina) permite clasificar los mielomas en tres estadios con distinta “cantidad de mieloma” y con distinto pronóstico.
¿Cuál es el tratamiento del mieloma múltiple?
Los primeros tratamientos para el mieloma datan de los años sesenta y se basaban en la combinación de corticoides con un grupo de agentes quimioterápicos llamados alquilantes. Estos fármacos siguen formando parte indispensable del tratamiento del mieloma, pero desde finales del pasado siglo, la adición de otros fármacos ha cambiado de forma muy importante el pronóstico de la enfermedad. Estos nuevos fármacos pertenecen sobre todo a dos familias, los llamados “inmunomoduladores” (talidomida, lenalidomida, pomalidomida) y los “inhibidores del proteasoma” (bortezomib, carfilzomib, ixazomib). No se consideran agentes quimioterápicos en el sentido convencional de la palabra, lo que no quiere decir que no tengan también algunos efectos indeseables.
En general, ninguno de estos fármacos se emplea aisladamente, su uso combinando dificulta que el mieloma múltiple desarrolle resistencias y permite un control más rápido de los síntomas. En general, un tratamiento más intenso y más prolongado con una combinación de fármacos se traduce en una eficacia mayor y una mayor duración de la respuesta. Sin embargo, la intensidad y duración del tratamiento deben modularse para evitar un exceso de toxicidad. La individualización del tratamiento, por tanto, dependerá de la capacidad del paciente para tolerar tratamientos más o menos intensivos. En este sentido, la edad es un factor muy relevante, aunque no el único a considerar.

En pacientes relativamente jóvenes (hasta los 65 o 70 años) y con un estado general adecuado, se intenta un tratamiento lo más intensivo posible, incluyendo un trasplante autólogo de progenitores de médula ósea. El motivo de ello es que los alquilantes (y en concreto, el alquilante que se usa habitualmente para el mieloma, el melfalan) son muy tóxicos para las células de la médula ósea. Emplear melfalan en dosis muy altas implica aumentar su eficacia pero también destruir de forma irreversible mucha celularidad sana de la médula ósea, por tanto, para administrar altas dosis de melfalan es necesario recoger previamente células progenitoras de la médula ósea, administrar las dosis altas de melfalan y posteriormente reinfundir células sanas para que las células de la sangre puedan recuperarse.
En pacientes jóvenes y sin otros problemas de salud graves, un tratamiento estándar podría ser una combinación de inmunomodulador, un inhibidor del proteasoma y un corticoide durante 4 – 6 ciclos (tratamiento de inducción) seguido de altas dosis de melfalan con trasplante autólogo de progenitores y, si es posible, añadir todavía más tratamiento después del trasplante (tratamientos de consolidación o de mantenimiento). Así lo regímenes más frecuentemente usados en España son VTD (bortezomib, talidomida, dexametasona) y VRD (bortezomib, lenalinomida y dexametasona), VCD (donde se usa ciclofosfamida en vez de un inmunomodulador). Ya hay aprobación para una terapia cuádruple en la que se incluye un anticuerpo denominado daratumumab (dirigido a CD38, que es una molécula expresada en las células plasmáticas) junto a VTD y que acabará sustituyendo a los regímenes anteriores en los pacientes candidatos a trasplante y sin contraindicaciones.
En pacientes en los que un trasplante no sea aconsejable por su excesiva toxicidad, se suele emplear una combinación de tres fármacos, que puede incluir también melfalan aunque en dosis más bajas, o combinaciones de sólo dos fármacos, incluyendo siempre un inhibidor del proteasoma, un inmunomodulador o ambos. En todo caso, el tratamiento debe adaptarse a la fragilidad del paciente para evitar un exceso de toxicidad, se puede intentar mantener los tratamientos con dos fármacos o bien con tres fármacos a dosis reducidas o espaciadas de forma continuada y con ello, obtener resultados cercanos a los obtenidos con tratamientos más intensivos.
El tratamiento de las recaídas también suele ser una combinación de dos o tres fármacos. Para la elección del tratamiento es importante considerar: la respuesta a los tratamientos previos (se pueden repetir tratamientos administrados anteriormente tan solo si con ellos se obtuvieron buenos resultados), la toxicidad de los tratamientos anteriores (hay que evitar fármacos que ya produjeron demasiada toxicidad), las características de la recaída y las opciones de tratamiento posteriores en caso de fracaso.
En conclusión, existen diversos fármacos útiles para el tratamiento del mieloma múltiple pero es importante individualizar bien el tratamiento, en función de la edad y las características del paciente y de la enfermedad.
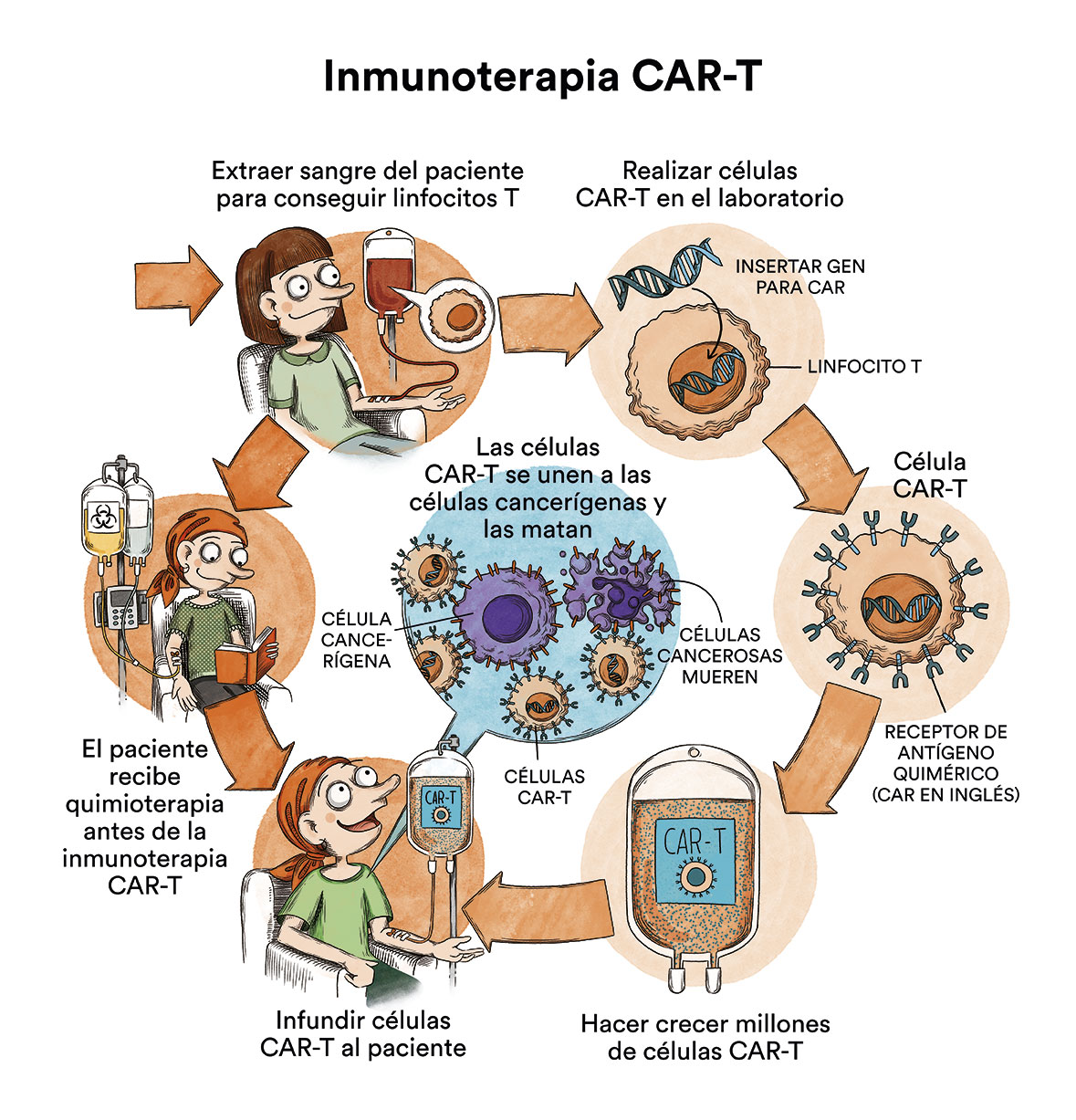
En los últimos años también ha aparecido la inmunoterapia CART que, hoy en día, también puede ser de aplicación en ciertos pacientes de mieloma múltiple seleccionados. El idecabtagene vicleucel (ide-cel, Abecma) y el ciltacabtagene autoleucel (cilta-cel, Carvykti) son terapias de células CAR-T dirigidas a la proteína BCMA, la cual está presente en las células del mieloma múltiple. Estos tratamientos pueden usarse en pacientes que ya se hayan sometido a varios tipos de otros tratamientos (por lo menos 4, generalmente) para combatir el mieloma múltiple. Sólo pueden administrarse en centros de referencia autorizados para ello.

Juanma
Mieloma múltiple.
“Me diagnosticaron un mieloma múltiple en 2018. Desde entonces me he sometido a seis líneas de tratamiento que han ido fallando una detrás de otra, pero a la séptima, tras un tratamiento de inmunoterapia CART, escuché por primera vez la estrofa más maravillosa del mundo: Juanma, la enfermedad está en remisión total. No hay rastro de células tumorales. a enfermedad está ahora mismo controlada. Cuando te dicen que estás en remisión total no significa que estés curado porque se supone que el mieloma múltiple de momento es incurable y puede haber recaídas, pero soy más optimista que nunca”.
¿Qué pronóstico tienen los pacientes de mieloma múltiple?
El mieloma múltiple se considera todavía una enfermedad incurable. La mayor parte de pacientes sufrirán recaídas tras el tratamiento inicial de la enfermedad y necesitarán volver a tratarse, probablemente en varias ocasiones. Eso no quiere decir que el pronóstico sea muy malo, de hecho, es extremadamente variable. Una pequeña proporción de pacientes (hasta un 10%) tendrán una excelente respuesta al tratamiento de primera línea y es posible que no recaigan nunca, llamamos a estos pacientes “funcionalmente curados” ya que nunca tenemos la seguridad de que el MM no vaya a reaparecer, aunque hayan pasado 10 o 15 años libres de enfermedad. En el otro extremo hay un 10-15% de pacientes que pueden ser resistentes al tratamiento inicial o bien responder inicialmente, pero recaer muy pronto. El pronóstico vital en estos casos es muy malo, alrededor de los dos años. Entre estos dos extremos, la mayoría de los pacientes van a responder adecuadamente al tratamiento inicial, sus síntomas van a desaparecer o mejorar mucho tras las primeras semanas de tratamiento y no van a tener un riesgo vital a corto o medio plazo.
Aun así, el pronóstico a largo plazo es más incierto, ya que dependerá de la frecuencia y agresividad de las recaídas. Incluso con un pronóstico vital similar, pacientes con recaídas poco agresivas y buena tolerancia a los tratamientos pueden tener una calidad de vida excelente durante años, mientras que otros con recaídas agresivas o bien con mala tolerancia a los distintos fármacos, pueden arrastrar secuelas que la reduzcan de forma importante. Por tanto, se trata de una enfermedad con un pronóstico muy variable, y aunque buena parte del estudio diagnóstico inicial se encamina a intentar predecir el tipo de MM al que nos enfrentamos, ninguna prueba es adecuada para anticipar un pronóstico exacto, ni en tiempo ni en calidad de vida.
El comportamiento clínico inicial del MM y sobre todo la respuesta al primer tratamiento, nos dará mucha información pronóstica. En pacientes que presenten una respuesta muy duradera al primer tratamiento, la respuesta al segundo y sucesivos tratamientos suele ser también buena y en esos casos podemos pensar en el MM como si se tratase de una enfermedad crónica. La situación es totalmente distinta en pacientes que tras un tratamiento recaen muy pronto o recaen de forma muy brusca y requieren otro tratamiento enseguida. Las recaídas bruscas favorecen la acumulación de secuelas (especialmente la insuficiencia renal y las lesiones óseas) y estas no sólo afectan a la calidad de vida, sino que con frecuencia reducen las opciones de tratamiento siguientes.
Es importante anticiparse y evitar las secuelas de la enfermedad y los problemas relacionados con la toxicidad de los tratamientos realizando un seguimiento riguroso de los pacientes con MM, tanto si están recibiendo tratamiento activo como en el tiempo en que están libres de síntomas.
Vivir con el mieloma múltiple: alimentación y cuidados
Los tratamientos para el mieloma tienen toxicidad que hay que vigilar y prevenir, pero no impiden llevar una vida prácticamente normal. Hay dos aspectos que el paciente debe vigilar especialmente: las infecciones y las lesiones óseas.
Los pacientes con mieloma tienen un riesgo de padecer infecciones 10 veces superior a la población sana. Este riesgo es más alto cuando el mieloma no está controlado, en la etapa inicial de cualquier tratamiento y sobre todo en el mieloma avanzado. Aun así, en pacientes que tienen el MM bajo control y que no requieren tratamiento en ese momento, el riesgo de infección es superior al de la población sana. Las infecciones de las vías respiratorias son las más frecuentes y también las potencialmente más graves. El riesgo de padecer una infección no es prevenible, pero ciertas medidas básicas ayudan a reducir el número de episodios. Extremar la higiene, evitar el contacto directo con familiares o personas con procesos infecciosos activos o evitar en la medida de lo posible las aglomeraciones en épocas de gripe es recomendable. En la transmisión por contacto, el lavado frecuente de manos es la medida más importante, en situaciones especiales (por ejemplo salas de espera de hospitales) y en momentos de especial sensibilidad (por ejemplo después de un trasplante) puede ser que se le recomiende llevar una mascarilla para evitar gérmenes de transmisión por el aire. Otras medidas sencillas son una nutrición equilibrada y variada (no son necesarios compuestos vitamínicos ni suplementos), una buena hidratación, ejercicio moderado (mejor al aire libre) y evitar el tabaco o los ambientes cargados.
Las lesiones óseas causadas por el MM se recuperan muy lentamente y la fragilidad ósea debe considerarse como permanente incluso tras un tratamiento exitoso. Es importante prevenir los aplastamientos vertebrales evitando levantar o acarrear pesos importantes. El ejercicio moderado refuerza la musculatura y favorece la recalcificación ósea pero no son recomendables deportes de contacto o que impliquen movimientos bruscos y violentos por el riesgo de padecer fracturas. Aunque uno de los síntomas del mieloma es la hipercalcemia (exceso de calcio en sangre), los alimentos ricos en calcio (quesos, lácteos) están claramente recomendados. El tratamiento del mieloma suele incluir unos fármacos llamados bifosfonatos que ayudan al hueso a recuperarse captando calcio del torrente sanguíneo. Por este motivo, a los pacientes con mieloma en tratamiento con bifosfonatos se les recomienda una dieta rica en calcio o suplementos de calcio y vitamina D ya que tienen con mucha más frecuencia el calcio sanguíneo bajo.
Recomendamos informarse sobre ¿cómo llevar una alimentación sana durante el tratamiento? Y sobre ejercicios de actividad física y fisioterapia recomendados (Manual fisioterapia en pacientes onco-hematológicos) y programa EnforMMA.
Enlaces de interés sobre temas médicos relacionados con el mieloma múltiple
- Guia del Mieloma Multiple del Grupo español del Mieloma, 2021
- Mieloma múltiple. AEAL
- Mieloma Múltiple. American Cancer Society
- Comunidad Española de Pacientes con Mieloma Múltiple
- Mieloma múltiple. Portal Clínic. Hospital Clínic de Barcelona.
- La guía sobre el mieloma: información para pacientes y cuidadores. Leukemia & Lymphoma Society
Enlaces de interés sobre otros temas relacionados con el mieloma múltiple
- Guía práctica sobre mieloma múltiple para pacientes y cuidadores. Fundación Josep Carreras contra la leucemia
- Guía del Trasplante de Médula ósea. Fundación Josep Carreras contra la leucemia
- Las lesiones óseas en el mieloma múltiple. Fundación Josep Carreras contra la leucemia
- Consejos de viaje para personas con cáncer. Fundación Josep Carreras contra la leucemia
- ¿Qué llevarme a una cámara de aislamiento? Fundación Josep Carreras contra la leucemia
- Manual de fisioterapia para pacientes hematológicos y trasplantados. Fundación Josep Carreras contra la leucemia
- Necrosis de cadera tras el tratamiento de una hemopatía maligna. Fundación Josep Carreras contra la leucemia
- Prevención y tratamiento de la mucositis oral. Fundación Josep Carreras contra la leucemia
- La higiene buco-dental en el paciente onco-hematológico. Fundación Josep Carreras contra la leucemia
- Manual de fertilidad: padecer un cáncer y ser padre o madre. Fundación Josep Carreras contra la leucemia
- El cuidado de la piel en el paciente onco-hematológico. Fundación Josep Carreras contra la leucemia
- Manual de Estética oncológica. Fundación Josep Carreras contra la leucemia
Enlaces de interés: entidades locales/provinciales o estatales que pueden proveerte de recursos y servicios especializados en leucemia o en pacientes oncológicos
En España existe un gran tejido asociativo para pacientes con cáncer hematológico que, en muchos casos, puede informarte, asesorarte e incluso, realizar algunos trámites Estos son los contactos de algunas de ellas por Comunidades Autónomas:
Todas estas organizaciones son externas a la Fundación Josep Carreras.
ESTATAL
- CEMMP (Comunidad Española de Pacientes de Mieloma Múltiple) Comunidad Española de Pacientes con Mieloma Múltiple | CEMMP (comunidadmielomamultiple.com)
- AEAL (ASOCIACIÓN ESPAÑOLA DE AFECTADOS POR LINFOMA, MIELOMA y LEUCEMIA)
- AECC (ASOCIACIÓN ESPAÑOLA CONTRA EL CÁNCER). Presente en las diferentes provincias y en muchas localidades. Contactar con la sede más cercana o llamando al 900 100 036 (24h).
- AELCLES (Agrupación Española contra la Leucemia y Enfermedades de la Sangre)
- FUNDACIÓN JOSEP CARRERAS CONTRA LA LEUCEMIA
- FUNDACIÓN SANDRA IBARRA
- GEPAC (GRUPO ESPAÑOL DE PACIENTES CON CÁNCER)
- MPN España (Asociación de Afectados Por Neoplasias Mieloproliferativas Crónicas)
ANDALUCÍA
- AECC (ASOCIACIÓN ESPAÑOLA CONTRA EL CÁNCER). Presente en las diferentes provincias y en muchas localidades. Contactar con la sede más cercana.
- ALUSVI (ASOCIACIÓN LUCHA Y SONRÍE POR LA VIDA). Sevilla
- APOLEU (ASOCIACIÓN DE APOYO A PACIENTES Y FAMILIARES DE LEUCEMIA). Cádiz
ARAGÓN
- AECC (ASOCIACIÓN ESPAÑOLA CONTRA EL CÁNCER). Presente en las diferentes provincias y en muchas localidades. Contactar con la sede más cercana.
- ASPHER (ASOCIACIÓN DE PACIENTES DE ENFERMEDADES HEMATOLÓGICAS RARAS DE ARAGÓN)
- DONA MÉDULA ARAGÓN
ASTURIAS
- AECC (ASOCIACIÓN ESPAÑOLA CONTRA EL CÁNCER). Presente en las diferentes provincias y en muchas localidades. Contactar con la sede más cercana.
- ASTHEHA (ASOCIACIÓN DE TRASPLANTADOS HEMATOPOYÉTICOS Y ENFERMOS HEMATOLÓGICOS DE ASTURIAS)
CANTABRIA
- AECC (ASOCIACIÓN ESPAÑOLA CONTRA EL CÁNCER). Presente en las diferentes provincias y en muchas localidades. Contactar con la sede más cercana.
CASTILLA LA MANCHA
- AECC (ASOCIACIÓN ESPAÑOLA CONTRA EL CÁNCER). Presente en las diferentes provincias y en muchas localidades. Contactar con la sede más cercana.
CASTILLA LEÓN
- ABACES (ASOCIACIÓN BERCIANA DE AYUDA CONTRA LAS ENFERMEDADES DE LA SANGRE)
- AECC (ASOCIACIÓN ESPAÑOLA CONTRA EL CÁNCER). Presente en las diferentes provincias y en muchas localidades. Contactar con la sede más cercana.
- ALCLES (ASOCIACIÓN LEONESA CON LAS ENFERMEDADES DE LA SANGRE). León.
- ASCOL (ASOCIACIÓN CONTRA LA LEUCEMIA Y ENFERMEDADES DE LA SANGRE). Salamanca.
CATALUÑA
- ASSOCIACIÓ FÈNIX. Solsona
- FECEC (FEDERACIÓ CATALANA D’ENTITATS CONTRA EL CÁNCER
- FUNDACIÓ KÁLIDA. Barcelona
- FUNDACIÓ ROSES CONTRA EL CÀNCER. Roses
- LLIGA CONTRA EL CÀNCER COMARQUES DE TARRAGONA I TERRES DE L’EBRE. Tarragona
- MielomaCAT
- ONCOLLIGA BARCELONA. Barcelona
- ONCOLLIGA GIRONA. Girona
- ONCOLLIGA COMARQUES DE LLEIDA. Lleida
- ONCOVALLÈS. Vallès Oriental
- OSONA CONTRA EL CÀNCER. Osona
- SUPORT I COMPANYIA. Barcelona
- VILASSAR DE DALT CONTRA EL CÀNCER. Vilassar de Dalt
COMUNIDAD VALENCIANA
- AECC (ASOCIACIÓN ESPAÑOLA CONTRA EL CÁNCER). Presente en las diferentes provincias y en muchas localidades. Contactar con la sede más cercana.
- ASLEUVAL (ASOCIACIÓN DE PACIENTES DE LEUCEMIA, LINFOMA, MIELOMA Y OTRAS ENFERMEDADES DE LA SANGRE DE VALENCIA)
EXTREMADURA
- AECC (ASOCIACIÓN ESPAÑOLA CONTRA EL CÁNCER). Presente en las diferentes provincias y en muchas localidades. Contactar con la sede más cercana.
- AFAL (AYUDA A FAMILIAS AFECTADAS DE LEUCEMIAS, LINFOMAS; MIELOMAS Y APLASIAS)
- AOEX (ASOCIACIÓN ONCOLÓGICA EXTREMEÑA)
GALICIA
- AECC (ASOCIACIÓN ESPAÑOLA CONTRA EL CÁNCER). Presente en las diferentes provincias y en muchas localidades. Contactar con la sede más cercana.
- ASOTRAME (ASOCIACIÓN GALLEGA DE AFECTADOS POR TRASPLANTES MEDULARES)
ISLAS BALEARES
- ADAA (ASSOCIACIÓ D’AJUDA A L’ACOMPANYAMENT DEL MALALT DE LES ILLES BALEARS)
- AECC (ASOCIACIÓN ESPAÑOLA CONTRA EL CÁNCER). Presente en las diferentes provincias y en muchas localidades. Contactar con la sede más cercana.
ISLAS CANARIAS
- AECC (ASOCIACIÓN ESPAÑOLA CONTRA EL CÁNCER). Presente en las diferentes provincias y en muchas localidades. Contactar con la sede más cercana.
- AFOL (ASOCIACIÓN DE FAMILIAS ONCOHEMATOLÓGICAS DE LANZAROTE)
- FUNDACIÓN ALEJANDRO DA SILVA
LA RIOJA
- AECC (ASOCIACIÓN ESPAÑOLA CONTRA EL CÁNCER). Presente en las diferentes provincias y en muchas localidades. Contactar con la sede más cercana.
MADRID
- AECC (ASOCIACIÓN ESPAÑOLA CONTRA EL CÁNCER). Presente en las diferentes provincias y en muchas localidades. Contactar con la sede más cercana.
- AEAL (ASOCIACIÓN ESPAÑOLA DE LEUCEMIA Y LINFOMA)
- CRIS CONTRA EL CÁNCER
- FUNDACIÓN LEUCEMIA Y LINFOMA
MURCIA
- AECC (ASOCIACIÓN ESPAÑOLA CONTRA EL CÁNCER). Presente en las diferentes provincias y en muchas localidades. Contactar con la sede más cercana.
NAVARRA
- AECC (ASOCIACIÓN ESPAÑOLA CONTRA EL CÁNCER). Presente en las diferentes provincias y en muchas localidades. Contactar con la sede más cercana.
PAÍS VASCO
- AECC (ASOCIACIÓN ESPAÑOLA CONTRA EL CÁNCER). Presente en las diferentes provincias y en muchas localidades. Contactar con la sede más cercana.
- PAUSOZ-PAUSO. Bilbao
CIUDADES AUTÓNOMAS DE CEUTA Y MELILLAS
- AECC CEUTA (ASOCIACIÓN ESPAÑOLA CONTRA EL CÁNCER)
- AECC MELILLA (ASOCIACIÓN ESPAÑOLA CONTRA EL CÁNCER)
Apoyo y ayuda
Te invitamos también a seguirnos a través de nuestras redes sociales principales (Facebook, Twitter e Instagram) en las que, a menudo, compartimos testimonios de superación.
Si resides en España, también puedes ponerte en contacto con nosotros enviándonos un correo electrónico a imparables@fcarreras.es para que te ayudemos a ponerte en contacto con otras personas que han superado esta enfermedad.
* De acuerdo con la Ley 34/2002 de Servicios de la Sociedad de la Información y el Comercio Electrónico (LSSICE), la Fundación Josep Carreras contra la Leucemia informa que toda la información médica disponible en www.fcarreras.org ha sido revisada y acreditada por el Dr. Enric Carreras Pons, Colegiado nº 9438, Barcelona, Doctor en Medicina y Cirugía, Especialista en Medicina Interna, Especialista en Hematología y Hemoterapia y Consultor senior de la Fundación; y por la Dra. Rocío Parody Porras, Colegiada nº 35205, Barcelona, Doctora en Medicina y Cirugía, Especialista en Hematología y Hemoterapia y adscrita a la Dirección médica del Registro de Donantes de Médula Ósea (REDMO) de la Fundación).
Información revisada en noviembre de 2023.